题目内容
下列关于反应能量的说法正确的是( )
| A、Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ/mol,E反应物>E生成物 | ||||
| B、CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ/mol,E反应物>E生成物 | ||||
C、HI(g)?
| ||||
| D、H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合后放热57.3 kJ |
考点:反应热和焓变
专题:
分析:A.反应物的能量大于生成物的能量为放热反应;
B.反应物的能量小于生成物的能量为吸热反应;
C.根据可逆反应的特点分析;
D.浓硫酸稀释放热.
B.反应物的能量小于生成物的能量为吸热反应;
C.根据可逆反应的特点分析;
D.浓硫酸稀释放热.
解答:
解:A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s);△H=-216kJ/mol,该反应为放热反应,则E反应物>E生成物,故A正确;
B.CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ/mol,该反应为吸热反应,则E反应物<E生成物,故B错误;
C.HI(g)?
H2(g)+
I2(s);△H=-26.5kJ/mol,该反应为可逆反应,则1mol HI不能全部分解,则在密闭容器中分解后放出的能量小于26.5kJ,故C错误;
D.H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合,由于浓硫酸稀释放热,所以反应后放热大于57.3 kJ,故D错误.
故选A.
B.CaCO3(s)=CaO(s)+CO2(g);△H=+178.5kJ/mol,该反应为吸热反应,则E反应物<E生成物,故B错误;
C.HI(g)?
| 1 |
| 2 |
| 1 |
| 2 |
D.H+(aq)+OH-(aq)=H2O(l);△H=-57.3kJ/mol,含1molNaOH水溶液与含0.5mol H2SO4的浓硫酸混合,由于浓硫酸稀释放热,所以反应后放热大于57.3 kJ,故D错误.
故选A.
点评:本题考查了反应热和焓变、中和热的概念,题目难度不大,注意把握可逆反应的特点.

练习册系列答案
 春雨教育同步作文系列答案
春雨教育同步作文系列答案
相关题目
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂.实验室可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+2CO2↑+K2SO4+2H2O.下列说法正确的是( )
| ||
| A、H2SO4是氧化剂 |
| B、ClO2是氧化产物 |
| C、H2C2O4在反应中被氧化 |
| D、1 molKClO3参加反应有2mol电子转移 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、2.8g乙烯中含有共价键的数目为0.5NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个 |
| B、1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个 |
| C、2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个 |
| D、0.1mol/L的H3PO4溶液中,c(H+):c(PO43-)<3:1 |
下列关于晶体的说法一定正确的是( )
| A、分子晶体中都存在共价键 |
| B、金属晶体的熔点都比分子晶体的熔点高 |
| C、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
D、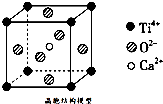 某物质晶胞结构如图,该物质的化学式为CaTiO3(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) |
在水溶液中能大量共存的一组离子是( )
| A、Ca2+、Al3+、Br-、CO32- |
| B、Pb2+、Hg2+、S2-、SO3- |
| C、NH4+、H+、S2O32-、PO43- |
| D、Na+、Ba2+、Cl-、NO3- |
05L 1mol/L的FeCl3与0.2L 1mol/L的KCl 溶液中,Cl-的物质的量浓度之比为( )
| A、5:2 | B、1:1 |
| C、3:1 | D、1:3 |
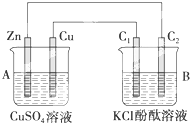 按如图所示装置进行实验,并回答下列问题:
按如图所示装置进行实验,并回答下列问题: