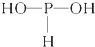题目内容
现有镁、铝、铜三种金属组成的混合物1.2g,若该混合物加入过量的稀盐酸中,在标准状况下产生氢气为1.12L.反应后过滤得到0.2g沉淀.
(1)求该混合物中铝的质量分数.
(2)若将等量的该混合物投入过量的烧碱溶液中反应,则产生氢气的体积(标准状况)是多少?
(1)求该混合物中铝的质量分数.
(2)若将等量的该混合物投入过量的烧碱溶液中反应,则产生氢气的体积(标准状况)是多少?
考点:有关混合物反应的计算
专题:
分析:(1)加盐酸发生Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,反应后过滤的沉淀0.2g为Cu的质量,设出镁、铝的物质的量,根据金属总质量、生成氢气的物质的量列式计算出各计算的物质的量,再计算出铝的质量及质量分数;
(2)将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据铝的物质的量计算出生成氢气在标况下的体积.
(2)将此合金放入过量的烧碱溶液中,发生2Al+2NaOH+2H2O=2NaAlO2+3H2↑,根据铝的物质的量计算出生成氢气在标况下的体积.
解答:
解:(1)由信息可知,Cu为0.2g,设Mg为xmol,Al为ymol,则
Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
根据金属质量可得:①24x+27y=1.2-0.2=1,
根据生成氢气的量可得:②x+1.5y=
=0.05,
解得:y=
mol,
混合物中铝的质量为:27g/mol×
mol=0.6g,
混合物中铝的质量分数为:
×100%=50%,
答:该混合物中铝的质量分数为50%;
(2)将此合金放入过量的烧碱溶液中,只发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
则生成气体体积为:
mol×
×22.4L/mol=0.747L,
答:反应在标况下大约能产生0.747升氢气.
Mg+2HCl=MgCl2+H2↑、2Al+6HCl=2AlCl3+3H2↑,
根据金属质量可得:①24x+27y=1.2-0.2=1,
根据生成氢气的量可得:②x+1.5y=
| 1.12L |
| 22.4L/mol |
解得:y=
| 1 |
| 45 |
混合物中铝的质量为:27g/mol×
| 1 |
| 45 |
混合物中铝的质量分数为:
| 0.6g |
| 1.2g |
答:该混合物中铝的质量分数为50%;
(2)将此合金放入过量的烧碱溶液中,只发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
则生成气体体积为:
| 1 |
| 45 |
| 3 |
| 2 |
答:反应在标况下大约能产生0.747升氢气.
点评:本题考查混合物的计算、根据方程式的计算,为高频考点,题目难度中等,注意可利用电子转移守恒计算氢气的物质的量或利用反应计算,试题有利于培养学生的化学计算能力.

练习册系列答案
相关题目
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、1L 0.1mol/L的Na2CO3溶液中,含Na+0.2 NA个,CO32-0.1 NA个 |
| B、1L 0.3mol/L的K2SO4溶液中,含K+和SO42-离子总数为0.9 NA个 |
| C、2L 0.6mol/L的Fe2(SO4)3溶液中,含SO42-离子总数为2.4 NA个 |
| D、0.1mol/L的H3PO4溶液中,c(H+):c(PO43-)<3:1 |
下列各组物质中,所含分子数相同的是 ( )
| A、10g H2和10g O2 |
| B、5.6L N2(标准状况)和11g CO2 |
| C、9g H2O和11.2L H2O(标准状况) |
| D、224mL H2(标准状况)和0.1molN2 |
可根据物质的组成或性质进行物质分类.下列物质分类中,只考虑组成的是( )
| A、Na2SO4是钠盐、硫酸盐、正盐 |
| B、HCl是一元酸、强酸、挥发性酸 |
| C、Fe2O3是金属氧化物、最高价氧化物、碱性氧化物 |
| D、Ca(OH)2是二元碱、微溶性碱、强碱 |
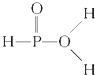
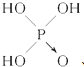 )中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )
)中三个氢原子都可以跟重水(D2O)中氘原子发生交换,又知次磷酸(H3PO2)也能跟D2O进行氢交换,次磷酸钠(NaH2PO2)却不能再跟D2O发生氢交换,由此推断出次磷酸分子的结构是( )