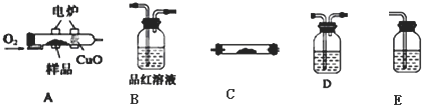
题目内容
 实验室用下列方法测定某水样中O2的含量.
实验室用下列方法测定某水样中O2的含量.(1)实验原理
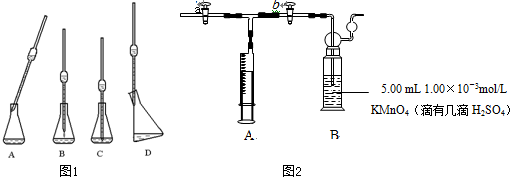
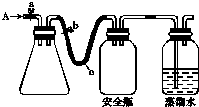
用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为
(2)实验步骤
①打开止水夹a 和b,从A 处向装置内鼓入过量N2,此操作的目的是
②用注射器抽取某水样20.00mL从A 处注入锥形瓶;
③再分别从A 处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A 处注人足量NaI溶液及含n mol H2SO4的硫酸溶液;⑥重复④的操作.
⑦取下锥形瓶,向其中加入2~3滴
⑧用0.005mol?L-1Na2S2O3 滴定至终点.
(3)数据分析
①若滴定过程中消耗的Na2S2O3 标准溶液体积为3.90mL,则此水样中氧(O2)的含量为
②若未用Na2S2O3 标准溶液润洗滴定管,则测得水样中O2的含量将
③实验要求加入适量的H2SO4使溶液接近中性,其原因是
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:(1)根据题中反应物和生成物,利用化合价升降相等配平;
(2)①测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果;
⑦根据反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,使用淀粉做指示剂;
(3)①根据反应原理找出反应的关系式,计算出试样中的氧含量;
②滴定管没有润洗,导致标准液浓度减小,消耗的标准液体积变大,氧气含量偏大;
③根据反应原理及硫代硫酸钠能够与酸反应分析.
(2)①测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果;
⑦根据反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,使用淀粉做指示剂;
(3)①根据反应原理找出反应的关系式,计算出试样中的氧含量;
②滴定管没有润洗,导致标准液浓度减小,消耗的标准液体积变大,氧气含量偏大;
③根据反应原理及硫代硫酸钠能够与酸反应分析.
解答:
解:(1)溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,锰元素化合价升高2价,氧气化合价降低了4价,根据化合价升高降低相等配平反应的离子方程式为:2Mn2++O2+4OH-=2MnO(OH)2,
故答案为:2Mn2++O2+4OH-=2MnO(OH)2;
(2)①由于测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果,
故答案为:赶走装置内空气,避免空气中的O2的干扰;
⑦由于反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,可以选用淀粉做指示剂,
故答案为:淀粉溶液;
(3)①发生的反应有:2Mn2++O2+4OH-=2MnO(OH)2、MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2Na2S2O3=2NaI+Na2S4O6,
氧气反应的关系式为:O2~2MnO(OH)2~2I2~4Na2S2O3,
1000mL水样中含有的氧气的物质的量是:n(O2)=
n(Na2S2O3)×
=0.25×0.005mol?L-1×0.0039L×50=2.4375×10-4mol,
氧气的质量为:2.4375×10-4mol×32g/mol=7.8mg,
此水样中氧(O2)的含量为7.8mg?L-1,
故答案为:7.8mg?L-1;
②若未用Na2S2O3 标准溶液润洗滴定管,会导致标准液的浓度减小,消耗的标准液的体积增大,测定结果偏大,
故答案为:偏大
③由于加入稀H2SO4使MnO(OH)2充分转化为Mn2+,但加入稀H2SO4的量时不宜过多,否则后续滴定过程中Na2S2O3与过量的酸反应导致消耗的Na2S2O3溶液偏大,导致消耗的Na2S2O3溶液偏大;
故答案为:若碱过量,则Mn(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应导致消耗的Na2S2O3溶液偏大.
故答案为:2Mn2++O2+4OH-=2MnO(OH)2;
(2)①由于测定的是水样中氧气含量,必须将装置中的空气赶走,避免干扰测定结果,
故答案为:赶走装置内空气,避免空气中的O2的干扰;
⑦由于反应中有碘单质参与,利用碘遇到淀粉显示蓝色的特性,可以选用淀粉做指示剂,
故答案为:淀粉溶液;
(3)①发生的反应有:2Mn2++O2+4OH-=2MnO(OH)2、MnO(OH)2+2I-+4H+=Mn2++I2+3H2O、I2+2Na2S2O3=2NaI+Na2S4O6,
氧气反应的关系式为:O2~2MnO(OH)2~2I2~4Na2S2O3,
1000mL水样中含有的氧气的物质的量是:n(O2)=
| 1 |
| 4 |
| 1000 |
| 20 |
氧气的质量为:2.4375×10-4mol×32g/mol=7.8mg,
此水样中氧(O2)的含量为7.8mg?L-1,
故答案为:7.8mg?L-1;
②若未用Na2S2O3 标准溶液润洗滴定管,会导致标准液的浓度减小,消耗的标准液的体积增大,测定结果偏大,
故答案为:偏大
③由于加入稀H2SO4使MnO(OH)2充分转化为Mn2+,但加入稀H2SO4的量时不宜过多,否则后续滴定过程中Na2S2O3与过量的酸反应导致消耗的Na2S2O3溶液偏大,导致消耗的Na2S2O3溶液偏大;
故答案为:若碱过量,则Mn(OH)2不能全部转变为Mn2+,而酸过量时,滴定过程中Na2S2O3可与酸反应导致消耗的Na2S2O3溶液偏大.
点评:本题考查了水样中氧气含量的测定,涉及的内容较多,本题难度较大,需要分析实验原理并联系滴定知识合理完成,充分考查了学生的分析、理解能力.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
下列关于晶体的说法一定正确的是( )
| A、分子晶体中都存在共价键 |
| B、金属晶体的熔点都比分子晶体的熔点高 |
| C、SiO2晶体中每个硅原子与两个氧原子以共价键相结合 |
D、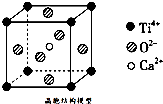 某物质晶胞结构如图,该物质的化学式为CaTiO3(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点) |
下列说法正确的是( )
| A、可用丁达尔效应区分胶体与溶液 |
| B、生石灰与水混合过程只发生物理变化 |
| C、臭氧是由三个氧原子构成的化合物 |
| D、CuSO4?H2O是一种混合物 |
短周期元素R的最高价氧化物对应的水化物的化学式为HxROy,其气态氢化物的化学式为HzR(或RHz),已知1mol HxROy比1mol HzR的质量多64克,下列说法不正确的是( )
| A、有多种元素符合本题条件 |
| B、符合本题的HxROy有一元酸和多元酸 |
| C、z与x的数值相等 |
| D、R可能是第二周期元素 |