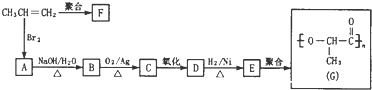
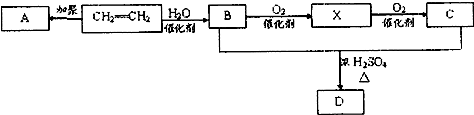
题目内容
A、B、C、D、E都为短周期元素,A是所有元素中相对原子质量最小的;B的+2价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布;D在C的下一周期,可与B形成BD2型离子化合物;E和C为同一周期元素,其最高价氧化物的水化物为强酸.
(1)五种元素的元素符号:A 、B 、C 、D 、E .
(2)B的原子结构示意图为: ;其在周期表中的位置是第 周期,第 主族.
(3)用电子式表示B与C形成化合物的过程: .
(1)五种元素的元素符号:A
(2)B的原子结构示意图为:
(3)用电子式表示B与C形成化合物的过程:
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A、B、C、D、E都为短周期元素,A是所有元素中相对原子质量最小的,则A为氢元素,B的+2价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布,则B为镁元素,C为氟元素,D在C的下一周期,可与B形成BD2型离子化合物,则D为氯元素,E和C为同一周期元素,其最高价氧化物的水化物为强酸,则E为氮元素,据此答题.
解答:
解:A、B、C、D、E都为短周期元素,A是所有元素中相对原子质量最小的,则A为氢元素,B的+2价阳离子和C的-1价阴离子都与氖原子具有相同的电子层排布,则B为镁元素,C为氟元素,D在C的下一周期,可与B形成BD2型离子化合物,则D为氯元素,E和C为同一周期元素,其最高价氧化物的水化物为强酸,则E为氮元素,
(1)由上面的分析可知,A为H,B为Mg,C为F,D为Cl,E为N,故答案为:H;Mg;F;Cl;N;
(2)B为镁元素,它的原子结构示意图为: ;其在周期表中的位置是第三周期,第ⅡA族,
;其在周期表中的位置是第三周期,第ⅡA族,
故答案为: ;三;Ⅱ;
;三;Ⅱ;
(3)用电子式表示MgF2的过程为 ,
,
故答案为: .
.
(1)由上面的分析可知,A为H,B为Mg,C为F,D为Cl,E为N,故答案为:H;Mg;F;Cl;N;
(2)B为镁元素,它的原子结构示意图为:
 ;其在周期表中的位置是第三周期,第ⅡA族,
;其在周期表中的位置是第三周期,第ⅡA族,故答案为:
 ;三;Ⅱ;
;三;Ⅱ;(3)用电子式表示MgF2的过程为
 ,
,故答案为:
 .
.
点评:本题主要考查了原子结构示意图、电子式等知识,难度不大,解题的关键是元素推断,答题时注意把握原子结构与元素性质的关系.

练习册系列答案
相关题目
标准状况下2.24L由H2和Cl2组成的混合气体,经光照充分反应后缓缓通入100mL 1mol?L-1 NaOH溶液中,测得所得溶液中,测定所得溶液中NaClO的浓度为0.1mol?L-1 (假设溶液体积不变),则原混合气体中H2和Cl2的体积比为( )
| A、1:1 | B、2:3 |
| C、6:9 | D、9:11 |
现有三组溶液:①汽油和氯化钠溶液,②39%的酒精溶液,③氯化钠和单质溴的水溶液.分离以上各混合液的正确方法依次是( )
| A、过滤、萃取、分液 |
| B、萃取、分液、蒸馏 |
| C、分液、蒸馏、萃取 |
| D、萃取、蒸馏、分液 |
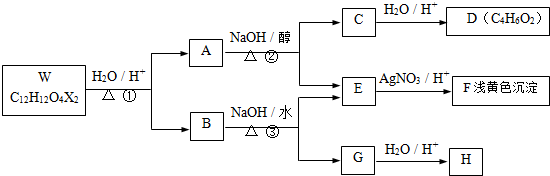
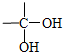
 ,反应④的化学方程式是
,反应④的化学方程式是