题目内容
标准状况下2.24L由H2和Cl2组成的混合气体,经光照充分反应后缓缓通入100mL 1mol?L-1 NaOH溶液中,测得所得溶液中,测定所得溶液中NaClO的浓度为0.1mol?L-1 (假设溶液体积不变),则原混合气体中H2和Cl2的体积比为( )
| A、1:1 | B、2:3 |
| C、6:9 | D、9:11 |
考点:有关混合物反应的计算
专题:计算题
分析:标准状况下2.24LH2和Cl2组成的混合气体的物质的量为0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,故混合气体中氯气的物质的量大于0.05mol,NaOH的物质的量为0.1L×1mol/L=0.1mol,由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由钠原子与氯原子关系可知,NaOH不足,根据n=cV计算NaClO的物质的量,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O计算与剩余氯气反应的NaOH的物质的量,进而计算与HCl反应的NaOH的物质的量,再计算HCl的物质的量,根据氢元素守恒计算氢气的物质的量,进而计算原混合气体中H2和Cl2的体积比.
解答:
解:标准状况下2.24LH2和Cl2组成的混合气体的物质的量为:
=0.1mol,最终有NaClO生成,说明氢气与氯气反应氯气有剩余,由于氢气与氯气按1:1反应,故混合气体中氯气的物质的量大于0.05mol,
NaOH的物质的量为:n(NaOH)=0.1L×1mol/L=0.1mol,
由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由Na原子与Cl原子关系可知,NaOH不足,反应生成NaClO的物质的量为0.1L×0.1mol/L=0.01mol,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O可知,与剩余氯气反应的NaOH的物质的量为:0.01mol×2=0.02mol,
故与HCl反应的NaOH的物质的量为:0.1mol-0.02mol=0.08mol,由HCl+NaOH=NaCl+H2O可知,HCl的物质的量为0.08mol,
根据氢元素守恒可知氢气的物质的量为:
=0.04mol,
故混合物中氯气的物质的量为:0.1mol-0.04mol=0.06mol,
相同条件下气体的体积之比等于其物质的量之比,
则原混合气体中H2和Cl2的体积比为:0.04mol:0.06mol=2:3,
故选B.
| 2.24L |
| 22.4L/mol |
NaOH的物质的量为:n(NaOH)=0.1L×1mol/L=0.1mol,
由于HCl与NaOH反应生成NaCl,Cl2与NaOH反应生成NaCl、NaClO,由Na原子与Cl原子关系可知,NaOH不足,反应生成NaClO的物质的量为0.1L×0.1mol/L=0.01mol,根据方程式Cl2+2NaOH=NaClO+NaCl+H2O可知,与剩余氯气反应的NaOH的物质的量为:0.01mol×2=0.02mol,
故与HCl反应的NaOH的物质的量为:0.1mol-0.02mol=0.08mol,由HCl+NaOH=NaCl+H2O可知,HCl的物质的量为0.08mol,
根据氢元素守恒可知氢气的物质的量为:
| 0.08mol |
| 2 |
故混合物中氯气的物质的量为:0.1mol-0.04mol=0.06mol,
相同条件下气体的体积之比等于其物质的量之比,
则原混合气体中H2和Cl2的体积比为:0.04mol:0.06mol=2:3,
故选B.
点评:本题考查混合物的有关计算,难度较大,根据氯原子与钠原子关系,判断混合气体反应后剩余的氯气与氢氧化钠反应氢氧化钠的量不足是解题关键,为易错题,容易认为剩余的氯气被氢氧化钠完全吸收.

练习册系列答案
相关题目
分离下列三组混合物依次采取的方法正确的是:①氯化钠溶液和鸡蛋清 ②植物油和氯化钠溶液 ③碳酸钙和氯化钙的溶液( )
| A、渗析、蒸馏、萃取 |
| B、渗析、分液、过滤 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
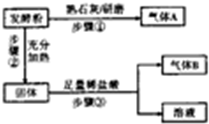 发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验:
发酵粉是一种复合添加剂,主要用作面制品和膨化食品的生产,由小苏打、碳酸氢铵和明矾中的两种物质组成.某研究性学习小组为探究不同品牌的发酵粉的化学成分,进行如下实验:
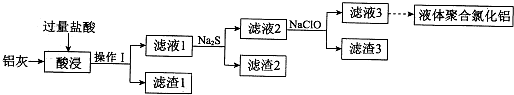
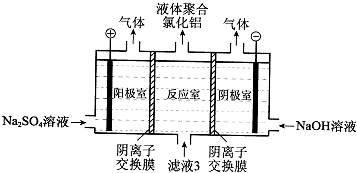
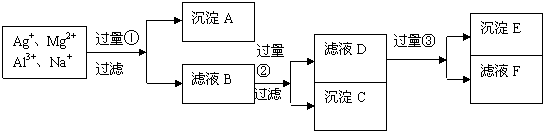


 Ⅰ、阅读、分析下列两个材料:
Ⅰ、阅读、分析下列两个材料: