题目内容
已知下列热化学方程式:①H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1
②H2(g)+
O2(g)=H2O(g)△H=-241.8kJ?mol-1
③C(s)+
O2(g)=CO(g)△H=-110.5kJ?mol-1
④C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1,
回答下列问题:
(1)上述反应中属于放热反应的是 .
(2)H2的燃烧热为 ;C的燃烧热为 .
(3)燃烧10g H2生成液态水,放出的热量为 .
(4)又查得资料有下列热化学方程式:
⑤CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式 .
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1,
回答下列问题:
(1)上述反应中属于放热反应的是
(2)H2的燃烧热为
(3)燃烧10g H2生成液态水,放出的热量为
(4)又查得资料有下列热化学方程式:
⑤CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式
考点:热化学方程式,反应热和焓变
专题:化学反应中的能量变化
分析:(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热;
(3)燃烧10g H2生成液态水,依据热化学方程式①计算;
(4)根据已知的热化学方程式结合盖斯定律计算.
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热;
(3)燃烧10g H2生成液态水,依据热化学方程式①计算;
(4)根据已知的热化学方程式结合盖斯定律计算.
解答:
解:(1)热化学方程式中△H为负值的反应为放热反应,△H为正值的为吸热反应:①H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1
②H2(g)+
O2(g)=H2O(g)△H=-241.8kJ?mol-1
③C(s)+
O2(g)=CO(g)△H=-110.5kJ?mol-1
④C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1,
以上4个反应均为放热反应,故答案为:①②③④;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,H2的燃烧热为285.8 kJ?mol-1,C的燃烧热为393.5kJ/mol,
故答案为:285.8 kJ?mol-1;393.5kJ/mol;
(3)依据反应①进行计算燃烧10g H2生成液态水放出的热量;
H2(g)+
O2(g)=H2O(l)△H=-285.8kJ?mol-1
2g 285.8kJ
10g Q
Q=
=1429kJ,故答案为:1429 kJ;
(4)已知 ④C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
①H2(g)+
O2(g)═H2O(l)△H2=-285.8kJ/mol
⑤CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律④×2-⑤+①×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-285.8kJ/mol)×2=-488.3 kJ/mol,
故答案为:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△=-488.3 kJ/mol.
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③C(s)+
| 1 |
| 2 |
④C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1,
以上4个反应均为放热反应,故答案为:①②③④;
(2)1mol纯净物完全燃烧生成稳定的氧化物所放出的热量为燃烧热,H2的燃烧热为285.8 kJ?mol-1,C的燃烧热为393.5kJ/mol,
故答案为:285.8 kJ?mol-1;393.5kJ/mol;
(3)依据反应①进行计算燃烧10g H2生成液态水放出的热量;
H2(g)+
| 1 |
| 2 |
2g 285.8kJ
10g Q
Q=
| 10g×285.8KJ |
| 10g |
(4)已知 ④C(s)+O2(g)═CO2(g)△H1=-393.5kJ/mol
①H2(g)+
| 1 |
| 2 |
⑤CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H3=-870.3kJ/mol
依据盖斯定律④×2-⑤+①×2得到
2C(s)+2H2(g)+O2(g)═CH3COOH(l)△H=(-393.5kJ/mol)×2-(-870.3kJ/mol)+(-285.8kJ/mol)×2=-488.3 kJ/mol,
故答案为:2C(s)+2H2(g)+O2(g)═CH3COOH(l)△=-488.3 kJ/mol.
点评:本题考查了放热反应的判断、燃烧热的概念应用、盖斯定律的应用,侧重于反应热的计算的考查,题目难度中等.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目
分离下列三组混合物依次采取的方法正确的是:①氯化钠溶液和鸡蛋清 ②植物油和氯化钠溶液 ③碳酸钙和氯化钙的溶液( )
| A、渗析、蒸馏、萃取 |
| B、渗析、分液、过滤 |
| C、分液、过滤、加热升华 |
| D、蒸馏、萃取、分液 |
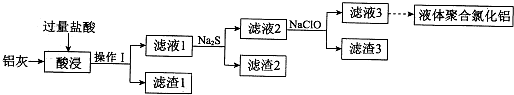
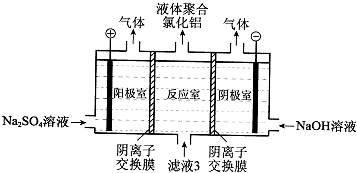


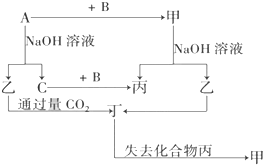 由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有如图示的转换关系,已知C为密度最小的气体,甲是电解质.