题目内容
8.现有部分元素的性质与原子(或分子)结构如表所示:| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 周期表中原子半径最小的元素 |
| T | 最外层电子数是次外层电子数的3倍 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
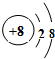 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式
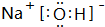 .
.(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
分析 X是周期表中原子半径最小的元素,则X为H元素;T的最外层电子数是次外层电子数的3倍,最外层电子数不能超过8,原子只能由2个电子层,最外层电子数为6,则T为O元素;Y原子的M层比K层少1个电子,则其M层电子数为1,故Y为Na;第三周期元素的金属离子中Z的离子半径最小,则Z为Al.
解答 解:X是周期表中原子半径最小的元素,则X为H元素;T的最外层电子数是次外层电子数的3倍,最外层电子数不能超过8,原子只能由2个电子层,最外层电子数为6,则T为O元素;Y原子的M层比K层少1个电子,则其M层电子数为1,故Y为Na;第三周期元素的金属离子中Z的离子半径最小,则Z为Al.
(1)T为O元素,O2-离子结构示意图为: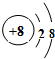 ,故答案为:
,故答案为: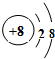 ;
;
(2)Na、Al同周期,随核电荷数增大金属性减弱,故Na的金属性较强,
a.单质的熔点属于物理性质,不能比较金属性强弱,故a错误;
b.金属性强弱与失去电子能与有关,与失去电子数目多少无关,即与化合价高低无关,故b错误;
c.金属单质与水反应越剧烈,数目金属性越强,故c正确;
d.金属性越强,最高价氧化物对应的水化物的碱性越强,故d正确,
故答案为:Na;cd;
(3)由T、X、Y共同形成既有离子键又有共价键的化合物为NaOH,该化合物的电子式为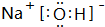 ,
,
故答案为: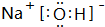 ;
;
(4)Z的氧化物为氧化铝,Y的最高价氧化物的水化物为NaOH,二者反应生成偏铝酸钠与水,反应的离子方程式:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O.
点评 本题考查结构性质物质关系应用,注意对元素周期律的理解掌握,掌握金属性、非金属性强弱比较实验事实.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.工业制粗硅的反应为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.下列说法正确的是( )
| A. | SiO2为分子晶体,Si为原子晶体 | |
| B. | Si是光导纤维的主要成分 | |
| C. | 在该反应条件下,C的氧化性强于Si的氧化性 | |
| D. | 每生成1 mol Si理论上转移的电子数目约为4×6.02×1023 |
19.下列离子方程式不正确的是( )
| A. | 少量碳酸氢铵溶液与足量烧碱溶液混合加热:NH4++OH-$\stackrel{△}{→}$NH3↑+H2O | |
| B. | 氨气通入稀硫酸中:NH3+H+→NH4+ | |
| C. | 稀氨水与稀盐酸混合:NH3?H2O+H+→NH4++H2O | |
| D. | 铜片溶于稀硝酸:3Cu+8H++2NO3-→3Cu2++2NO↑+4H2O |
16.除去下列物质中的杂质(括号中为杂质),所用试剂和方法错误的是( )
| A. | Cu (CuO),加盐酸,过滤 | B. | NaCl (I2)固体,加热升华 | ||
| C. | KNO3 (K2SO4),加BaCl2溶液,过滤 | D. | MgO (Al2O3),加烧碱溶液,过滤 |
3.下列物质中含有共价键的离子化合物是( )
| A. | H2O | B. | CaCl2 | C. | NH4Cl | D. | HCl |
13.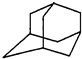 如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )
如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )
 如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )
如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )| A. | 金刚烷的分子中有18个碳原子 | |
| B. | 1-溴金刚烷的结构有2种 | |
| C. | 金刚烷属于烷烃的同系物 | |
| D. | 金刚烷应该具有和芳香烃相似的化学性质 |
20.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,36g18O2中所含的中子数为16NA | |
| B. | 8.0g Cu2S和CuO的混合物中含有铜原子数为0.1NA | |
| C. | 电解饱和食盐水时,阳极上生成22.4L气体时转移的电子数为2NA | |
| D. | 标准状况下,2.24 LCl2溶于水中达到饱和,可得到HClO分子的数目是0.1NA |
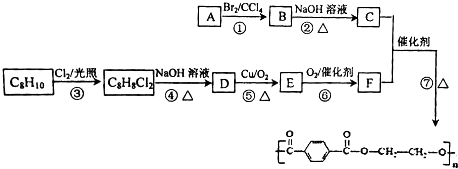
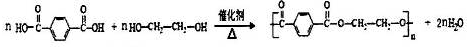
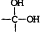 →
→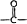 +H2O
+H2O .
.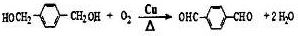 ;
; .
.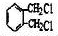 .
.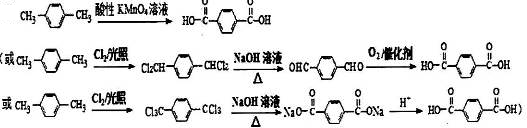 (有机物用结构简式表示,无机试剂任选).
(有机物用结构简式表示,无机试剂任选).