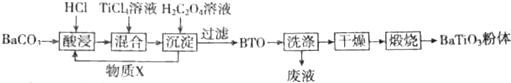
题目内容
3.下列物质中含有共价键的离子化合物是( )| A. | H2O | B. | CaCl2 | C. | NH4Cl | D. | HCl |
分析 活泼金属和活泼非金属之间易形成离子键,非金属元素之间易形成共价键,离子化合物中一定含有离子键可能含有共价键,共价化合物中一定不含离子键,据此分析解答.
解答 解:A、水是共价化合物,水分子中氧原子和氢原子之间只存在共价键,故A错误.
B、氯化钙是离子化合物,氯化钙中氯离子和钙离子之间只存在离子键,故B错误.
C、氯化铵是离子化合物,氯化铵中氯离子和铵根离子之间存在离子键,铵根离子中氮原子和氢原子之间存在共价键,故C正确.
D、HCl是共价化合物,HCl分子中氢原子和氯原子之间只存在共价键,故D错误.
故选C.
点评 本题考查了离子化合物和共价化合物、离子键和共价键的判断,难度不大,明确元素和元素之间的成键是解答本题的关键,

练习册系列答案
 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案
相关题目
13. 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
2NH4++2e-=2NH3↑+H2↑.电池总反应为:2MnO2(s)+Zn(s)+NH4+(aq)=2MnO(OH)(s)+[Zn(NH3)2]2+(aq).
请回答下列问题:
(1)电池的负极反应式为Zn+2NH4+-2e-=[Zn(NH3)2]2++2H+.
(2)对干电池不能进行加热或充电,否则会有可能发生爆炸.
(3)废电池糊状填充物经溶解、过滤,得到无色滤液和黑色滤渣.某课外活动小组对该滤液和滤渣进行了探究.已知:滤液的成份是氯化锌和氯化铵;Zn(OH)2是两性氢氧化物.
I.取少量滤液于试管中,滴入适量NaOH溶液产生白色沉淀至沉淀刚开始溶解,并字不要微热,生成无色刺激性气体,检验该气体的方法是将湿润的红色石蕊试纸靠近试管口,试纸变蓝.继续往试管中滴入FeCl3溶液,白色沉淀部分转化为红褐色沉淀,则可判断Zn(OH)2的Ksp大于Fe(OH)3的Ksp(填“大于”、“小于”、“不能判断”),写出该反应的离子方程式3Zn(OH)2 (s)+2Fe3+(aq)=2Fe(OH)3(s)+3Zn2+(aq).
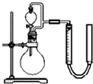
II.从黑色滤渣分离出二氧化锰,探究其在用H2O2制备O2过程中的作用.实验装置如图所示,将等量的H2O2溶液加入烧瓶中,分别进行2次实验(气体体积在相同条件下测定).
为了准确读取量气管读数,读数时视线应与左管凹液面最低处相平,还应注意读数前上下移动右管,使两管液面保持同一高度,实验1中MnO2的作用是催化剂,则实验2中反应的离子方程式为H2O2+2H++MnO2=Mn2++2H2O+O2↑.
(4)用废电池的锌皮制作七水合硫酸锌(含少量金属铁),其流程如下:
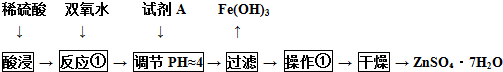
试剂A是ZnO(填化学式),操作①包括蒸发浓缩、冷却结晶、过滤、洗涤等操作,其过程中所需的仪器有酒精灯、玻璃棒、漏斗和下列仪器中的bd(填字母).(铁架台及夹持仪器略)
a.坩埚 b.蒸发皿 c.圆底烧瓶 d.小烧杯
(5)ZnSO4•7H2O晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式Zn3(CO3)(OH)4.
 锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:
锌锰干电池是最早使用的化学电池,酸性锌锰干电池以锌筒为负极,正极材料是二氧化锰粉、氯化铵及碳黑组成的糊状混合物,中间插入一根碳棒,正极和负极之间有一层用氯化铵和氯化锌溶液浸透了的隔离纸.工作时正极上会发生反应:2NH4++2e-=2NH3↑+H2↑.电池总反应为:2MnO2(s)+Zn(s)+NH4+(aq)=2MnO(OH)(s)+[Zn(NH3)2]2+(aq).
请回答下列问题:
(1)电池的负极反应式为Zn+2NH4+-2e-=[Zn(NH3)2]2++2H+.
(2)对干电池不能进行加热或充电,否则会有可能发生爆炸.
(3)废电池糊状填充物经溶解、过滤,得到无色滤液和黑色滤渣.某课外活动小组对该滤液和滤渣进行了探究.已知:滤液的成份是氯化锌和氯化铵;Zn(OH)2是两性氢氧化物.
I.取少量滤液于试管中,滴入适量NaOH溶液产生白色沉淀至沉淀刚开始溶解,并字不要微热,生成无色刺激性气体,检验该气体的方法是将湿润的红色石蕊试纸靠近试管口,试纸变蓝.继续往试管中滴入FeCl3溶液,白色沉淀部分转化为红褐色沉淀,则可判断Zn(OH)2的Ksp大于Fe(OH)3的Ksp(填“大于”、“小于”、“不能判断”),写出该反应的离子方程式3Zn(OH)2 (s)+2Fe3+(aq)=2Fe(OH)3(s)+3Zn2+(aq).
II.从黑色滤渣分离出二氧化锰,探究其在用H2O2制备O2过程中的作用.实验装置如图所示,将等量的H2O2溶液加入烧瓶中,分别进行2次实验(气体体积在相同条件下测定).
| 序号 | 烧瓶中的物质 | 气体体积 | MnO2的作用 |
| 实验1 | 足量MnO2 | 56mL | |
| 实验2 | 足量MnO2和稀硫酸 | 112mL |
(4)用废电池的锌皮制作七水合硫酸锌(含少量金属铁),其流程如下:

试剂A是ZnO(填化学式),操作①包括蒸发浓缩、冷却结晶、过滤、洗涤等操作,其过程中所需的仪器有酒精灯、玻璃棒、漏斗和下列仪器中的bd(填字母).(铁架台及夹持仪器略)
a.坩埚 b.蒸发皿 c.圆底烧瓶 d.小烧杯
(5)ZnSO4•7H2O晶体溶解于饱和Na2CO3溶液中,得到6.46g的碱式碳酸锌[Znx(CO3)y(OH)z],为了测定其组成,充分加热分解,产生的气体依次通入浓硫酸和碱石灰,质量分别增重了0.72g和0.88g,则该碱式碳酸锌的化学式Zn3(CO3)(OH)4.
14.下列有关物质的保存方法正确的是( )
| A. | 浓硝酸保存在棕色带橡胶塞的试剂瓶中 | |
| B. | 漂粉精露置在空气中 | |
| C. | 烧碱溶液可保存在带玻璃塞试剂瓶中 | |
| D. | 可用铝制容器存放浓硫酸 |
18.近期我国冀东渤海湾发现储量达10亿吨的大型油田.下列关于石油的说法正确的是( )
| A. | 石油主要含有碳、氢两种元素 | B. | 石油属于可再生矿物能源 | ||
| C. | 石油的裂化是化学变化 | D. | 石油分馏的各馏分均是纯净物 |
8.现有部分元素的性质与原子(或分子)结构如表所示:
(1)写出元素T的离子结构示意图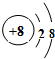 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式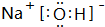 .
.
(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 周期表中原子半径最小的元素 |
| T | 最外层电子数是次外层电子数的3倍 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
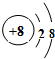 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式
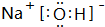 .
.(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
15.常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7,下列说法中正确的是( )
| A. | 该现象说明了NaHCO3难溶于水 | |
| B. | 滤液中的c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 滤液中c(Na+)+c(H+)+c(NH4+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| D. | 滤液中c(Cl-)>c(NH4+)>c(HCO3-)>c(H+)>c(OH-) |
12.NA为阿伏伽德罗常数的值.下列说法错误的是( )
| A. | 等质量的H2O与CH2D2含有的质子数相同 | |
| B. | 室温下CH3COONH4溶液pH=7,1L 0.1mol•L-1该溶液中NH4+离子数为0.1NA | |
| C. | 标准状况下,6.72 L NO2与水充分反应转移的电子数为0.2NA | |
| D. | 1mol CH3COOC2H5在足量NaOH溶液中水解得到乙醇分子数为NA |