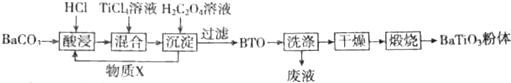
题目内容
2.25℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下列各题.(1)若a+b=14,2Va=Vb,碱是NaOH,反应后所得溶液pH小于7.由此你能得到的结论是酸是一种弱酸.
(2)若a+b=13,酸是盐酸,碱是b=12的KOH,现用盐酸滴定50.00mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸的体积V=11.11mL.
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是$\frac{7}{2}$<a<$\frac{14}{3}$_.
分析 (1)酸中c(H+)=10-pH mol•L-1=10-amol•L-1,碱中c(OH-)=10pH-14 mol•L-1=10b-14 mol•L-1=10-amol•L-1,可见酸中c(H+)与碱中c(OH-)相等,2Va=Vb混合后溶液的pH小于7,说明溶液呈酸性,应为弱酸与强碱的组合;
(2)酸中c(H+)=10-pH mol•L-1=10-amol•L-1,碱中c(OH-)=10pH-14 mol•L-1=10b-14 mol•L-1=10-(a+1)mol•L-1,据滴定过程中,氢离子浓度=$\frac{n({H}^{+})}{{V}_{混合液}}$计算.
(3)pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,恰好中和,则有Va×10-a=Vb×10b-14,结合Va<Vb,a=0.5b计算.
解答 解:(1)解:pH=a的酸的溶液中c(H+)=10-pH mol•L-1=10-amol•L-1,
a+b=14,则pH=b的碱中c(OH-)=10pH-14 mol•L-1=10b-14 mol•L-1=10-amol•L-1,
可见酸中c(H+)与碱中c(OH-)相等,2Va=Vb混合后溶液的pH小于7,说明溶液呈酸性,应为弱酸与强碱的组合,
故答案为:酸是一种弱酸;
(2)酸中c(H+)=10-pH mol•L-1=10-amol•L-1,碱中c(OH-)=10pH-14 mol•L-1=10b-14 mol•L-1=10-(a+1)mol•L-1,pH=2时,c(H+)=10-2mol/L=$\frac{1{0}^{-1}mol/L×VL-1{0}^{-(a+1)}×0.05L}{VL+0.05L}$,解得:V=0.0111L=11.11mL,
故答案为:11.11;
(3)pH=b的某一元强碱溶液呈碱性,则b>7,
a=0.5b,则a>0.5×7=3.5,即a>$\frac{7}{2}$;
pH=a的强酸c(H+)=10-amol/L,pH=b的强碱c(OH-)=10b-14mol/L,恰好中和,则有Va×10-a=Vb×10b-14,
可得:$\frac{{V}_{a}}{{V}_{b}}$=10a+b-14,
Va<Vb,则10a+b-14<1,即:a+b<14,又a=0.5b,则a+2a<14,
3a<14,则a<$\frac{14}{3}$,
所以:$\frac{7}{2}$<a<$\frac{14}{3}$,
故答案为:$\frac{7}{2}$<a<$\frac{14}{3}$.
点评 本题考查了酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握溶液pH的概念及表达式,试题培养了学生的化学计算能力.

| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 周期表中原子半径最小的元素 |
| T | 最外层电子数是次外层电子数的3倍 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
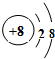 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式
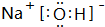 .
.(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| A. | $\overline{v}$(NH3)=0.01 mol/(L•s) | B. | $\overline{v}$(O2)=0.00l0 mol/(L•s) | ||
| C. | $\overline{v}$(NO)=0.00l0 mol/(L•s) | D. | $\overline{v}$(H2O)=0.045 mol/(L•s) |
| A. | 原子半径D>E>C>B | |
| B. | A、C、D、E四种元素形成的化合物溶于水一定显酸性 | |
| C. | C、D形成的化合物是离子化合物,只含有离子键 | |
| D. | A、C形成的化合物只有氧化性没有还原性 |
 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X的性质和元素组成是有还原性; 含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
| A. | 是指常温常压下,2个氢分子和1个氧分子反应生成2个水分子,放出热量571.6 kJ | |
| B. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(l),放出热量571.6 kJ | |
| C. | 是指标准状况下,2 mol H2O(l)分解为2 mol H2(g)和1 mol O2(g),吸收热量571.6 kJ | |
| D. | 是指常温常压下,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),放出热量571.6 kJ |
| 选项 | 化学反应及 离子方程式 | 评 价 |
| A | 醋酸钠溶于水:CH3COO-+H2O═CH3COOH+OH- | 正确 |
| B | 实验室用浓盐酸与MnO2反应制Cl2: MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O | 错误,反应物中HCl电离出的H+、Cl-比例为1:1 |
| C | 硝酸铁溶液中加过量氨水:Fe3++3NH3•H2O═Fe(OH)3(胶体)+3NH4+ | 错误,Fe(OH)3应该是沉淀 |
| D | 铝溶于碳酸中:2Al+3H2CO3═2Al3++3H2+3 CO32- | 正确 |
| A. | A | B. | B | C. | C | D. | D |