题目内容
13.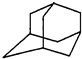 如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )
如图是金刚烷的结构示意图,1-溴金刚烷可用于合成甲型流感病毒的抑制剂.下列有关说法中正确的是( )| A. | 金刚烷的分子中有18个碳原子 | |
| B. | 1-溴金刚烷的结构有2种 | |
| C. | 金刚烷属于烷烃的同系物 | |
| D. | 金刚烷应该具有和芳香烃相似的化学性质 |
分析 A.金刚烷含有10个碳原子;
B.分子中含有-CH2、-CH-两种基团;
C.含有环,与烷烃结构不同;
D.金刚烷不含苯环.
解答 解:A.金刚烷含有10个碳原子,故A错误;
B.分子中含有-CH2、-CH-两种基团,含有2种氢原子,1-溴金刚烷的结构有2种,故B正确;
C.烷烃为链烃,而金刚烷含有环,与烷烃结构不同,故C错误;
D.金刚烷不含苯环,含饱和碳原子,不能发生加成反应,故D错误.
故选B.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质,难度不大,易错点为B,注意结构特点的判断.

练习册系列答案
相关题目
3.下列指定反应的离子方程式正确的是( )
| A. | 用强碱溶液吸收硝酸工业的尾气:NO+NO2+2OH-═2NO2-+H2O | |
| B. | NH4HCO3溶液与足量NaOH溶液共热:NH4++HCO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+NH3↑+2H2O | |
| C. | 明矾净水:Al3++3H2O═Al(OH)3↓+3H+ | |
| D. | 苯酚加入NaHCO3溶液中:C6H5OH+HCO3-→C6H5O-+CO2↑+H2O |
4.从某些性质来看,NH3和H2O、NH4+和H+、NH2-和OH-、N3-和O2-两两类似.据此判断,下列反应中正确的是( )
①NH4Cl+NaNH2$\stackrel{△}{→}$NaCl+2NH3↑
②CaO+2NH4Cl$\stackrel{△}{→}$CaCl2+2NH3↑+H2O
③3Mg(NH2)2$\stackrel{△}{→}$Mg3N2+4NH3↑
①NH4Cl+NaNH2$\stackrel{△}{→}$NaCl+2NH3↑
②CaO+2NH4Cl$\stackrel{△}{→}$CaCl2+2NH3↑+H2O
③3Mg(NH2)2$\stackrel{△}{→}$Mg3N2+4NH3↑
| A. | 仅①正确 | B. | ②③正确 | C. | ①③正确 | D. | 全部正确 |
8.现有部分元素的性质与原子(或分子)结构如表所示:
(1)写出元素T的离子结构示意图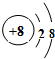 .
.
(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式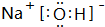 .
.
(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
| 元素编号 | 元素性质与原子(或分子)结构 |
| X | 周期表中原子半径最小的元素 |
| T | 最外层电子数是次外层电子数的3倍 |
| Y | M层比K层少1个电子 |
| Z | 第三周期元素的金属离子中半径最小 |
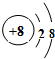 .
.(2)元素Y与元素Z相比,金属性较强的是Na(用元素符号表示),下列表述中能证明这一事实的是cd(填字母).
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物对应的水化物的碱性比Z的强
(3)由T、X、Y共同形成既有离子键又有共价键的化合物,写出该化合物的电子式
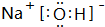 .
.(4)Z的氧化物和Y 的最高价氧化物的水化物反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
18.下列分子中的各原子不可能在同一平面上的是( )
| A. | C2H4 | B. | CH3CH3 | C. | CH2═CHCl | D. | C2H2 |
2.设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
| A. | 25℃时,1L pH=13的Ba(OH)2溶液中含有OH一的数目为0.2NA | |
| B. | 取50mL 14.0moI/L浓硝酸与足量的铜片反应,生成气体分子的数目为0.35NA | |
| C. | 标准状况下,2.24L二氧化硫中含有的电子总数为3.2NA | |
| D. | 40g金刚砂(SiC)中含有C-Si键的个数为2NA |
7. 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X的性质和元素组成是有还原性; 含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.
 某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.
某学生对Na2SO3与AgNO3在不同的pH下反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者水解的离子分别是SO32-、Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现 象 |
| a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是2Ag++SO32-=Ag2SO3↓.
②推测a中白色沉淀为Ag2SO4,推测的依据是SO32-有还原性,可能被氧化为SO42-,与Ag+反应生成Ag2SO4白色沉淀.
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2、BaCl2检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是检验X是否为Ag2O.
②根据上述现象,分析X的性质和元素组成是有还原性; 含有Ag元素,不含S元素.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)═AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析X产生的原因,认为随着酸性的增强,体系还原性增强.通过进一步实验确认了这种可能性,实验如下:
①气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O=2Ag+H2SO4.

 RCH2COOH$→_{红磷}^{Br_{2}}$
RCH2COOH$→_{红磷}^{Br_{2}}$ 请以2一甲基丙醇和甲醇为原料,设计制备有
请以2一甲基丙醇和甲醇为原料,设计制备有