题目内容
20.T℃时,AgCl在水溶液中的沉淀溶解平衡曲线如图所示.在该温度下,下列说法中不正确的是( )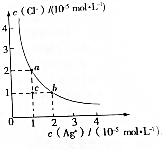
| A. | a点和b点对应的Ksp(AgCl)相等 | |
| B. | Ksp(AgCl)=2×10-10 | |
| C. | 可采取蒸发溶剂的方法使溶液从c点变到b点 | |
| D. | 已知Ksp(AgI)=8.5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=4.25×10-7 |
分析 在相同温度下,AgCl的溶度积为定值,随着浓度Cl-的增大,Ag+浓度逐渐减小,位于曲线的点a、b为平衡状态,即溶液达到饱和,c为不饱和状态,以此解答该题.
解答 解:A.在相同温度下,Kap相同,所以a点和b点对应的Ksp(AgCl)相等,故A正确;
B.由图象可知,AgCl的溶度积常数Ksp=1×10-5×2×10-5=2×10-10,故B正确;
C.蒸发溶液,Ag+浓度和Cl-浓度都增大,不可能为c点达到b点,故C错误;
D.当AgCl开始沉淀时,说明溶液中的c(I-)和c(Cl-)均已达到饱和状态,因此可以根据溶度积表达式进行计算,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=$\frac{Ksp(AgI)}{Ksp(AgCl)}$=$\frac{8.5×1{0}^{-17}}{2×1{0}^{-10}}$=4.25×10-7,故D正确.
故选C.
点评 本题考查难溶电解质的溶解平衡问题,题目难度中等,注意把握题给图象曲线的意义,根据图象中的数据计算溶度积常数,侧重于考查学生对基础知识的应用能力和计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 淀粉、纤维素都属天然高分子化合物 | |
| B. | 食品包装袋中可用碱石灰做干燥剂 | |
| C. | 煤经过液化等物理变化可转化为清洁燃料 | |
| D. | 制作航天服的聚醋纤维属新型无机非金属材料 |
11.曲酸是一种非常有潜力的食品添加剂,结构如图所示.下列有关曲酸的叙述不正确的是( )

| A. | 分子中所有碳原子可能共平面 | |
| B. | 既能发生酯化反应又能发生氧化反应 | |
| C. | 1 mol该物质与H2完全加成,需消耗3 mol H2 | |
| D. | 比该物质少一个O原子,属于芳香族化合物的同分异构体有2种 |
8.设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A. | 100mL1mol/LNa2CO3溶液中含有0.1NA个CO32- | |
| B. | 电解精炼铜时,若阴极得到电子数为2NA,则阳极质量减少64g | |
| C. | 1molCl2与过量Fe反应,转移的电子数为2 NA | |
| D. | 标准状况下,11.2L乙醇完全燃烧产生二氧化碳分子数为NA |
5.下列关于元素周期表和元素周期律的说法中正确的是( )
| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次增大 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点升高 |
12.在溶液中,反应A+2B?C分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100mol•L-1、c(B)=0.200mol•L-1及c(C)=0mol•L-1.反应物A的浓度随时间的变化如图所示.下列说法正确的是( )

| A. | 0min时,三个实验的瞬间速率相同 | |
| B. | 不考虑温度影响,10min时,实验③的瞬间速率最快 | |
| C. | 0~20min内,实验①、②化学平均速率相等 | |
| D. | 实验①、②相比,实验②可能加了催化剂 |
12.下列物质所属的类别及其所含官能团的对应关系不正确的是( )
| A. | CH3CH=CH2 烯烃 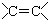 | B. | 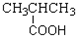 羧酸-COOH 羧酸-COOH | ||
| C. | 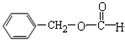 醛类 醛类 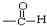 | D. | RCH2OH (R为烃基) 醇类-OH |
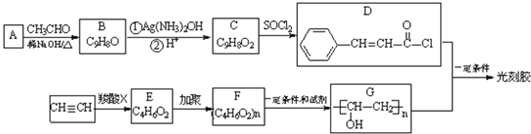
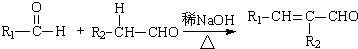 (R,R′为烃基或氢)
(R,R′为烃基或氢) (R,R′为烃基)
(R,R′为烃基)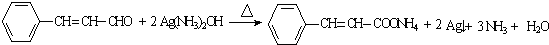 .
.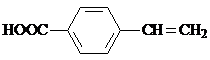 .
. .
. ,A、B、C形成的化合物的电子式为
,A、B、C形成的化合物的电子式为 .
.