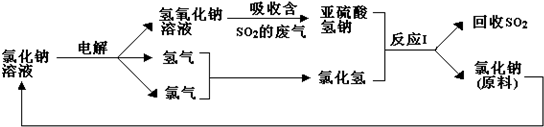
题目内容
5.下列关于元素周期表和元素周期律的说法中正确的是( )| A. | 在周期表中,元素的族序数都等于其原子的最外层电子数 | |
| B. | 周期表中非金属性最强的元素,其最高价氧化物的水化物酸性也最强 | |
| C. | 同主族元素随原子核电荷数的递增,原子半径依次增大 | |
| D. | 第ⅦA族元素的单质,随分子量的增大,熔、沸点升高;ⅠA族单质,随分子量的增大,熔、沸点升高 |
分析 A.主族元素的族序数等于最外层电子数;
B.周期表中非金属性最强的元素,为F,没有正价;
C.同主族从上到下原子半径增大;
D.ⅠA族碱金属单质,随原子序数增大,熔沸点降低.
解答 解:A.主族元素的族序数等于最外层电子数,副族元素不一定,故A错误;
B.周期表中非金属性最强的元素,为F,没有正价,则不存在最高价氧化物的水化物,故B错误;
C.同主族从上到下原子半径增大,则同主族元素随原子核电荷数的递增,原子半径依次增大,故C正确;
D.ⅠA族碱金属单质,随原子序数增大,熔沸点降低,而第ⅦA族元素的单质,随分子量的增大,熔、沸点升高,因晶体类型及作用力不同,故D错误;
故选C.
点评 本题考查周期表和周期律的应用,为高频考点,把握原子结构与元素的位置、元素的性质、元素周期律等为解答的关键,侧重分析与应用能力的考查,注意D中性质比较方法,题目难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
20.T℃时,AgCl在水溶液中的沉淀溶解平衡曲线如图所示.在该温度下,下列说法中不正确的是( )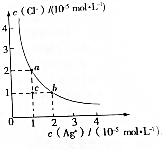

| A. | a点和b点对应的Ksp(AgCl)相等 | |
| B. | Ksp(AgCl)=2×10-10 | |
| C. | 可采取蒸发溶剂的方法使溶液从c点变到b点 | |
| D. | 已知Ksp(AgI)=8.5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=4.25×10-7 |
18.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子半径、失电子能力随核电荷数的增加而增大 | |
| B. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
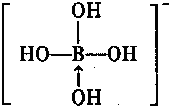 .(若存在配位键需标出)
.(若存在配位键需标出)
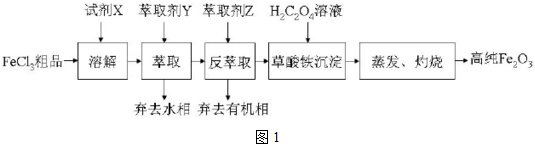
 .
.