题目内容
13.A、B、C、D是四种短周期元素,A元素所在的周期数、主族序数和原子序数均相等;B原子的最外层电子数是次外层电子数的3倍;C是第三周期原子半径最大的元素;D的单质工业上用于制漂白粉,也用于自来水的消毒.用元素符号或化学式回答下列问题:(1)C元素在周期表中的位置第三周期IA族,D的单质与水反应的离子方程式为Cl2+H2O=H++Cl-+HClO.
(2)C的离子结构示意图为
 ,A、B、C形成的化合物的电子式为
,A、B、C形成的化合物的电子式为 .
.(3)B、C形成的化合物可用作供氧剂,写出供氧时发生的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
分析 A、B、C、D是四种短周期元素,A元素所在的周期数、主族序数和原子序数均相等,则A为H元素;B原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故B为O元素;C是第三周期原子半径最大的元素,则C为Na;D的单质工业上用于制漂白粉,也用于自来水的消毒,则D为Cl.
解答 解:A、B、C、D是四种短周期元素,A元素所在的周期数、主族序数和原子序数均相等,则A为H元素;B原子的最外层电子数是次外层电子数的3倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为6,故B为O元素;C是第三周期原子半径最大的元素,则C为Na;D的单质工业上用于制漂白粉,也用于自来水的消毒,则D为Cl.
(1)C为Na元素,在周期表中的位置:第三周期IA族,氯气与水反应的离子方程式为:Cl2+H2O=H++Cl-+HClO,
故答案为:第三周期IA族;Cl2+H2O=H++Cl-+HClO;
(2)C的离子为Na+,离子结构示意图为 ,A、B、C形成的化合物为NaOH,电子式为
,A、B、C形成的化合物为NaOH,电子式为 ,
,
故答案为: ;
; ;
;
(3)B、C形成的化合物可用作供氧剂,该化合物为过氧化钠,供氧时发生的化学方程式:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查结构性质位置关系应用,侧重对化学用语与元素混合性质的考查,注意对基础知识的理解掌握.

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
20.T℃时,AgCl在水溶液中的沉淀溶解平衡曲线如图所示.在该温度下,下列说法中不正确的是( )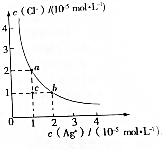

| A. | a点和b点对应的Ksp(AgCl)相等 | |
| B. | Ksp(AgCl)=2×10-10 | |
| C. | 可采取蒸发溶剂的方法使溶液从c点变到b点 | |
| D. | 已知Ksp(AgI)=8.5×10-17,向含KI和KCl的溶液中滴加AgNO3溶液,当AgCl开始沉淀时,溶液中$\frac{c({I}^{-})}{c(C{l}^{-})}$=4.25×10-7 |
4.能说明苯不是单双键交替的事实是( )
| A. | 苯的一氯代物只有一种 | B. | 苯的邻位二氯代物只有一种 | ||
| C. | 苯的间位二氯代物只有一种 | D. | 苯的对位二氯代物只有一种 |
1.关于如图所示的氢氧燃料电池的说法错误的是( )
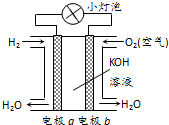

| A. | 电极a是负极 | |
| B. | 电极a上的电极反应为2H2-4e-=4H+ | |
| C. | 外电路中电子由电极a流向电极b | |
| D. | 氢氧燃料电池的优点是高效、对环境友好 |
18.下列关于F、Cl、Br、I性质的比较,不正确的是( )
| A. | 它们的原子半径、失电子能力随核电荷数的增加而增大 | |
| B. | 被其它卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大 | |
| C. | 它们的氢化物的稳定性随核电荷数的增加而增强 | |
| D. | 单质的颜色随核电荷数的增加而加深 |
5.下列物质中,只含有非极性共价键的是( )
| A. | Na2O2 | B. | KCl | C. | H2S | D. | N2 |
2.X、Y、Z和M是4种短周期元素,其中X、Y位于同一主族,Y与M、X与Z位于同一周期.X原子最外层电子数是其电子层数的3倍.Z原子的核外电子数比X原子少1.M是同周期中半径最大的元素(除稀有气体元素).下列说法正确的是( )
| A. | Y元素最高价氧化物对应水化物的化学式可表示为H2YO3 | |
| B. | Z和M组成的化合物与盐酸反应可以生成两种盐 | |
| C. | X、Y、Z元素的气态氢化物中,Y的沸点最高 | |
| D. | 四种元素简单离子的半径由大到小依次为Y>X>Z>M |
 . H2O2
. H2O2 NH4Cl
NH4Cl
 .
.
 .
.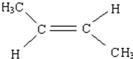 .
. CH2=CH2+(CH3)2C=C(CH3)2.
CH2=CH2+(CH3)2C=C(CH3)2.