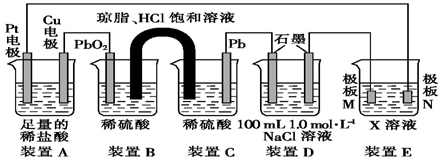
��Ŀ����
14��Na��Fe��Cl����ѧ��ѧ������Ԫ�أ��ش��������⣺��1��������Ԫ�صij����������У��ʵ���ɫ����Na2O2���ѧʽ����
��2����ɫ��Ӧ��ʵ���У�NaԪ��ȼ��ʱ����ɫΪ��ɫ���۲�KԪ��ȼ��ʱ����ɫ��Ҫ����ɫ�ܲ�����
��3��ʵ�������Ʊ�Fe��OH��2ʱ��������������������������ǰ�ɫ����Ѹ�ٱ�ɻ���ɫ
���ձ�ɺ��ɫ������
��4��MgO��̼�ۺ�������һ�������·�Ӧ���Ʊ�MgCl2���÷�Ӧ�Ļ�ѧ����ʽΪ2MgO+C+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$2MgCl2+CO2����β����������NaOH��Һ��ȫ���գ������ɵ���ΪNaCl��NaClO��Na2CO3��д��ѧʽ����
��5����NO��H2��CO2��ɵĻ�����壬��ͨ��������Na2O2��ַ�Ӧ���ٽ���������õ����ȼ����ַ�Ӧ������ֻ�õ���������Ϊ70%�����ᣬ����������ʣ�࣮��ԭ���������NO��H2��CO2�������Ϊ2��4��7��
���� ��1�������������й�������Ϊ����ɫ���壻
��2����Ԫ����ɫ��ӦΪ��ɫ���۲�K����ɫ��Ӧ��Ҫ��ɫ�ܲ�����ȥ�ƹ⣻
��3���Ʊ�Fe��OH��2ʱ����������������ױ��������������������������
��4��MgO��̼�ۺ�������һ�������·�Ӧ���Ʊ�MgCl2����Ӧ�����Ȼ�þ�Ͷ�����̼��β����������������̼����������NaOH��Ӧ��
��5���漰�ķ�Ӧ��2Na2O2+2CO2=2Na2CO3+O2��2H2+O2=2H2O��4NO+3O2+2H2O=4HNO3���õ�Ũ��Ϊ70%��������Һ��������Ϊ70g����ˮΪ30g������n��HNO3��=$\frac{70g}{63g/mol}$=$\frac{10}{9}$mol��n��H2O��=$\frac{30g}{18g/mol}$=$\frac{15}{9}$mol�����ݷ���ʽ��������غ���㣮
��� �⣺��1��������Ԫ�صij����������У��ʵ���ɫ����Na2O2���ʴ�Ϊ��Na2O2��
��2����Ԫ�ص���ɫ��ӦΪ��ɫ���۲�KԪ��ȼ��ʱ����ɫ��Ҫ����ɫ�겣��Ƭ���ʴ�Ϊ���ƣ���ɫ�ܲ�����
��3��ʵ�������Ʊ�Fe��OH��2ʱ�������������������������ԭ��Ӧ������������������������Ϊ��ɫ����Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ������
�ʴ�Ϊ����ɫ����Ѹ�ٱ�ɻ���ɫ�����ձ�ɺ��ɫ������
��4��MgO��̼�ۺ�������һ�������·�Ӧ���Ʊ�MgCl2��β����������������̼����Ӧ�Ļ�ѧ����ʽΪ��2MgO+C+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$2MgCl2+CO2����������NaOH��Һ��ȫ���գ������ɵ���ΪNaCl��NaClO��Na2CO3��
�ʴ�Ϊ��2MgO+C+2Cl2 $\frac{\underline{\;һ������\;}}{\;}$2MgCl2+CO2��NaCl��NaClO��Na2CO3��
��5���漰�ķ�Ӧ��2Na2O2+2CO2=2Na2CO3+O2��2H2+O2=2H2O��4NO+3O2+2H2O=4HNO3���õ�Ũ��Ϊ70%��������Һ��������Ϊ70g����ˮΪ30g������n��HNO3��=$\frac{70g}{63g/mol}$=$\frac{10}{9}$mol��n��H2O��=$\frac{30g}{18g/mol}$=$\frac{15}{9}$mol��
��
4NO+3O2 +2H2O=4HNO3
4 3 2 4
n��NO�� n1��O2�� n��H2O�� $\frac{10}{9}$mol
����n��NO��=$\frac{10}{9}$mol��
n��H2��=n��H2O��=$\frac{5}{9}$mol+$\frac{15}{9}$mol=$\frac{20}{9}$mol��
2H2 +O2 =2H2O
2 1 2
$\frac{20}{9}$mol $\frac{10}{9}$mol
n��O2��=$\frac{10}{9}$mol+$\frac{3}{4}$��$\frac{10}{9}$mol=$\frac{17.5}{9}$mol��
2Na2O2+2CO2=2Na2CO3+O2
2 1
n��CO2�� $\frac{17.5}{9}$mol
n��CO2��=2��$\frac{17.5}{9}$mol=$\frac{35}{9}$mol��
��n��NO����n��H2����n��CO2��=$\frac{10}{9}$mol��$\frac{20}{9}$mol��$\frac{35}{9}$mol=2��4��7���������Ϊ2��4��7��
�ʴ�Ϊ��2��4��7��
���� ���⿼�鳣������������������ʣ�Ϊ��Ƶ���㣬�������ʵ����ʡ������ķ�ӦΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��Ԫ�ػ�����֪ʶ���ۺ�Ӧ�ã���5���м���Ϊ�����ѵ㣬��Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�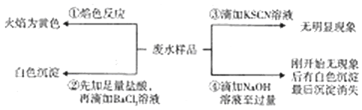
| A�� | ��ˮ����Na+������K+ | B�� | ��ˮ����SO42-��CO32- | ||
| C�� | ��ˮ����Fe3+�����ܺ�Fe2+ | D�� | ��ˮһ������Na+��Al3+��SO42-�� |
| A�� | 0.6 | B�� | 0.9 | C�� | 1.6 | D�� | 1.7 |
| A�� | 8.2mL��1.8mL | B�� | 5.6mL��4.4mL | C�� | 6.4mL��3.6mL | D�� | 3.5mL��6.5mL |
 ��Ȼ���д�����SԪ�أ��������������Ҫ�����ã�
��Ȼ���д�����SԪ�أ��������������Ҫ�����ã���1���������ӵĵ���ʽΪ
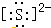 ��
���ڼ���ʱ����Ԫ�ص�����������Ӧˮ�����Ũ��Һ��ͭ��Ӧ�Ļ�ѧ����ʽΪCu+2H2SO4��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$CuSO4+SO2��+2H2O
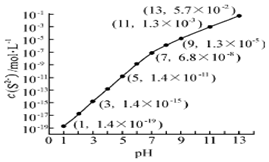
��2��25�棬��0.10mol•L-1H2S��Һ�У�ͨ��HCl��������NaOH�����Ե�����ҺpH����ҺpH��c��S2-����ϵ��ͼ��������Һ����ı仯��H2S�Ļӷ�����
��pH=13ʱ����Һ�е�c��H2S��+c��HS-��=0.043mol•L-1��
��ij��Һ��0.020mol•L-1Mn2+��0.10mol•L-1H2S������ҺpH=5ʱ��Mn2+��ʼ������[��֪��Ksp��MnS��=2.8��10-13]
��3��25�棬������ĵ���ƽ�ⳣ�������
| Ka1 | Ka2 | |
| H2SO3 | 1.3��10-2 | 6.3��10-4 |
| H2CO3 | 4.2��10-7 | 5.6��10-11 |
��H2SO3��Һ��NaHCO3��Һ��Ӧ����Ҫ���ӷ���ʽΪH2SO3+HCO3-=HSO3-+CO2��+H2O��
| ����Ļ�ѧʽ | CH3COOH | HCN | H2CO3 |
| ����ƽ�ⳣ�� | 1.8��10-5 | 4.9��l0-10 | K1=4.3��10-7����K2=5.6��10-11 |
| A�� | �����������μ�ˮ������ĵ���Ⱥ�pH��������С | |
| B�� | �����ʵ���Ũ�ȵĸ���ҺpH��ϵΪ��pH��NaCN����pH��Na2CO3����pH��CH3COONa�� | |
| C�� | 25��ʱ����CH3COOH��Һ��NaCN��Һ�У�ˮ�ĵ���̶�ǰ�ߴ� | |
| D�� | amol•L-1HCN��Һ��bmol•L-1NaOH��Һ�������ϣ�������Һ��c��Na+����c��CN-������bһ��С��a |
| A�� | ɭ����ҿ��ķ� | B�� | ����ʯȼ�ϵĴ���ȼ�� | ||
| C�� | �����ж�����̼�ĺ������� | D�� | �������ķ�ˮ�����ŷ� |
| A�� | 0.1mol•L-1NaHCO3��Һ��c��Na+����c��HCO3-����c��CO32-����c��H2CO3�� | |
| B�� | 0.1mol•L-1NaOH��Һ��ͨ��SO2������pH=7��c��Na+��=c��HSO3-��+2 c��SO32-��+c��H2SO3�� | |
| C�� | �����ʵ���Ũ�ȵ�CH3COOH��Һ��NaOH��Һ�������Ϻ�����pH=9����Һ��c��OH-��-c��CH3COOH��=c��H+��=l��10-9mol•L-1 | |
| D�� | 20 mL0.1mol•L-1CH3COONa��Һ��10 mL 0.1mol•L-1HCl��Һ��ϵõ�����Һ��c��CH3COOH��+2c��H+��=c��CH3COO-��+2c��OH-�� |