题目内容
19. 自然界中存在着S元素,它对生物具有重要的作用.
自然界中存在着S元素,它对生物具有重要的作用.(1)①硫离子的电子式为
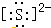 .
.②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应的化学方程式为Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
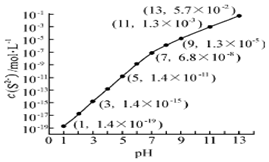
(2)25℃,在0.10mol•L-1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图(忽略溶液体积的变化、H2S的挥发),
①pH=13时,溶液中的c(H2S)+c(HS-)=0.043mol•L-1.
②某溶液含0.020mol•L-1Mn2+、0.10mol•L-1H2S,当溶液pH=5时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10-13]
(3)25℃,两种酸的电离平衡常数如表.
| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-4 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
②H2SO3溶液和NaHCO3溶液反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O.
分析 (1)①硫离子为阴离子,需要标出最外层电子及所带电荷;
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应反应生成硫酸铜、二氧化硫和水;
(2)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1;
②当Qc=Ksp(MnS)时开始沉淀,由此求出硫离子的浓度,结合图象得出此时的pH;
(3)①酸性强弱H2SO3>HSO3->H2CO3,对应盐水解程度HSO3-<SO32-<HCO3-,等浓度的NaHSO3和Na2SO3溶液中亚硫酸氢根离子电离程度大于其水解程度;
②由表可知H2SO3的二级电离小于H2CO3的一级电离,则酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O.
解答 解:(1)①硫离子为阴离子,需要标出最外层8个电子,硫离子的电子式为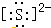 ,故答案为:
,故答案为: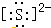 ;
;
②加热时,硫元素的最高价氧化物对应水化物的浓溶液与铜反应反应生成硫酸铜、二氧化硫和水,反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(2)①pH=13时,c(S2-)=5.7×10-2mol/L,在0.10mol•L-1H2S溶液中根据硫守恒c(H2S)+c(HS-)+c(S2-)=0.10mol•L-1,所以c(H2S)+c(HS-)=0.1-5.7×10-2=0.043mol/L,
故答案为:0.043;
②当Qc=Ksp(MnS)时开始沉淀,所以c(S2-)=$\frac{Ksp(MnS)}{c(M{n}^{2+})}$=$\frac{2.8×1{0}^{-13}}{0.020}$mol/L=1.4×10-11mol/L,结合图象得出此时的pH=5,所以pH=5时锰离子开始沉淀,
故答案为:5;
(3)①酸性强弱H2SO3>HSO3->H2CO3,对应盐水解程度HSO3-<SO32-<HCO3-,等浓度的NaHSO3和Na2SO3溶液中亚硫酸氢根离子电离程度大于其水解程度,溶液中离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(H+)>c(HSO3-)>c(OH-),
故答案为:c(Na+)>c(SO32-)>c(H+)>c(HSO3-)>c(OH-);
②由表可知H2SO3的二级电离小于H2CO3的一级电离,所以酸性强弱H2SO3>H2CO3>HSO3-,所以反应的主要离子方程式为H2SO3+HCO3-=HSO3-+CO2↑+H2O,而不是为H2SO3+2HCO3-=SO32-+2CO2↑+2H2O,
故答案为:H2SO3+HCO3-=HSO3-+CO2↑+H2O.
点评 本题考查了弱电解质电离平衡、盐类水解、水解平衡常数计算、溶液中守恒关系的计算是解题关键,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 1:1 | B. | 5:3 | C. | 33:11 | D. | 11:4 |
 用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )
用该装置进行粗铜精炼,粗铜中一般含有锌、铁、银、金等杂质(此题中不考虑其他杂质)在如图所示的装置中,接通电路一段时间后,其中一个电极质量增加了3.2g,在此过程中,下列说法正确的是( )| A. | 甲池化学能转化为电能,工作时OH-由a→b定向移动 | |
| B. | 通电时,整个电路中电流方向为b→c,d→a | |
| C. | 乙池中CuSO4溶液的浓度不变 | |
| D. | 电极d是纯铜,此过程中电子转移0.05mol |
| A. | 过滤 | B. | 蒸馏 | C. | 分液 | D. | 萃取 |
| A. | 用蘸有浓氨水的棉棒检验输送氯气的管道是否漏气 | |
| B. | 研发使用高效催化剂,可提高反应中原料的转化率 | |
| C. | 用K2FeO4取代Cl2处理饮用水,可杀菌消毒,还能沉降水中的悬浮物 | |
| D. | 高纯硅广泛应用于太阳能电池、计算机芯片和半导体器件的制造 |
| A. | 镁带燃烧可以用CO2灭火 | |
| B. | 单晶硅是重要的半导体材料,常用于制造光导纤维 | |
| C. | Cl2能使湿润的有色布条褪色,是因为Cl2的氧化性 | |
| D. | 金属钠可保存在煤油中 |
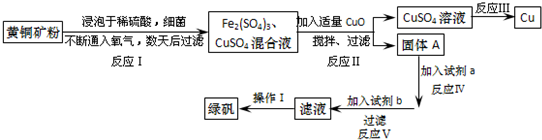
回答下列问题:
(1)已知:
| Fe2+ | Cu2+ | Fe3+ | |
| 开始转化成氢氧化物沉淀时的pH | 7.6 | 4.7 | 2.7 |
| 完全转化成氢氧化物沉淀时的pH | 9.6 | 6.7 | 3.7 |
(2)写出能实现反应Ⅲ的化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+2H2SO4+O2↑.
(3)试剂b为Fe.
(4)欲从滤液中获得绿矾晶体,操作Ⅰ应为浓缩、结晶、过滤.
(5)反应Ⅰ的化学方程式4CuFeS2+2H2SO4+17O2=4CuSO4+2Fe2(SO4)3+2H2O.