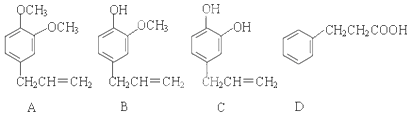
题目内容
10.NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 1L1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 标准状况下,22.4LSO3所含分子数为NA | |
| C. | 1mol 过氧化钠中阴离子所带电荷数为2NA | |
| D. | 0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
分析 A.氯化氢为强电解质,水中完全电离;
B.气体摩尔体积使用对象为气体;
C.过氧化钠中的阴离子为过氧根离子,1mol过氧化钠中含有1mol过氧根离子,1mol过氧根离子带有2mol负电荷;
D.氯气与氢氧化钠溶液发生歧化反应,氯气既是氧化剂又是还原剂.
解答 解:A.氯化氢为强电解质,水中完全电离,所以氯化氢溶液中不存在氯化氢分子,故A错误;
B.标况下三氧化硫不是气体,不能使用气体摩尔体积,故B错误;
C.1mol过氧化钠中含有1mol阴离子过氧根离子,带有的负电荷为2mol,所带电荷数为2NA,故C正确;
D.0.1molCl2与过量稀NaOH溶液发生歧化反应,转移的电子总数为0.1NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下三氧化硫不是气体、过氧化钠中的阴离子为过氧根离子;注意掌握以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
相关题目
18. 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.2}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
5. 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高,遇水会反应.Al2H6球棍模型如图.下列有关说法不正确的是( )| A. | 氢铝化合物可能成为未来的燃料 | |
| B. | Al2H6中含有非极性键 | |
| C. | Al2H6是分子晶体 | |
| D. | Al2H6与水反应生成氢氧化铝和氢气 |
15.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是( )
| A. | 电离程度:HCN>HClO | |
| B. | pH:HClO>HCN | |
| C. | 酸根离子浓度:c(CN-)<c(ClO-) | |
| D. | 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
2.用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 1molN2所含有的原子数为NA | |
| B. | 标准状况下,22.4L水中含有的水分子数为NA | |
| C. | Na2O2和CO2的反应中,每有1molNa2O2参加反应转移电子数为2NA | |
| D. | 16 gO2分子和16 gO3分子所含的氧原子数目相等 |
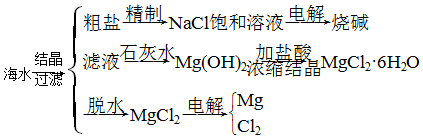

 ;
; .
.