题目内容
1.海水是取之不尽的化工原料资源,可以从海水中提取各种化工原料.下图是工业上对海水的几项综合利用的示意图: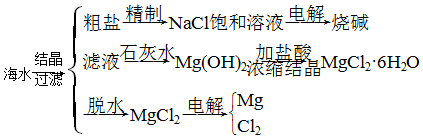
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A.盐酸;B.BaCl2溶液;C.NaOH溶液;D.Na2CO3溶液. 加入试剂的顺序是BCDA(或CBDA).
(2)电解饱和食盐水时,其产物氯气可用来制备漂白粉,反应方程式是2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O.
(3)海水中还可以提取溴,写出提取溴过程中在吸收塔中与SO2的反应方程式Br2+SO2+2H2O═2HBr+H2SO4.
(4)电解无水MgCl2反应方程式MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
分析 (1)根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析;
(2)氯气与石灰乳反应制备漂白粉;
(3)溴与二氧化硫发生氧化还原反应生成硫酸和HBr;
(4)工业用电解氯化镁的方法制备镁.
解答 解:(1)因用蒸发结晶的方法可以从海水中获得食盐,镁离子用氢氧根离子沉淀,加入过量的石灰乳可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,在进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以添加试剂的顺序为:CBDA或BDCA,
故答案为:BCDA(或CBDA);
(2)氯气和氢氧化钙反应生成氯化钙和次氯酸钙,方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,
故答案为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;
(3)溴与二氧化硫发生氧化还原反应生成硫酸和HBr,反应的化学方程式为Br2+SO2+2H2O═2HBr+H2SO4,故答案为:Br2+SO2+2H2O═2HBr+H2SO4;
(4)工业用电解氯化镁的方法制备镁,化学方程式为MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,故答案为:MgCl2$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
点评 本题考查了海水资源及其综合应用,题目难度中等,注意掌握化学实验基本操作方法,明确物质分离与提纯方法,特别是除杂试剂的加入顺序,试题培养了学生的分析、理解能力及化学实验能力.

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
| A. | 加入几滴硫酸铜溶液 | B. | 加入适量的水 | ||
| C. | 加入适量NaCl溶液 | D. | 再加入少量稀硫酸 |
| 实验目的 | 试剂(或条件) | |
| A | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
| B | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉 ②铁钉 |
| C | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水 ②蒸馏所得液体 |
| D | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 |

| A. | A | B. | B | C. | C | D. | D |
| A. | 1L1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 标准状况下,22.4LSO3所含分子数为NA | |
| C. | 1mol 过氧化钠中阴离子所带电荷数为2NA | |
| D. | 0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
 钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题.
钢铁工业是国家工业的基础.请回答钢铁冶炼、腐蚀、防护过程中的有关问题. ,D的电子排布式为1s22s22p63s23p2.
,D的电子排布式为1s22s22p63s23p2. .
.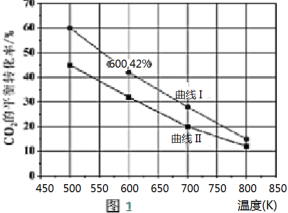 甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下:
甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,二氧化碳加氢合成甲醇是合理利用二氧化碳的有效途径.由二氧化碳制备甲醇过程中可能涉及反应如下: