题目内容
18. 在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )
在1.0L密闭容器中放入0.10 mol X,在一定温度下发生反应:X(g)?Y(g)+Z(g)△H<0 容器内气体总压强p随反应时间t的变化关系如图所示.以下分析正确的是( )| A. | 从反应开始到t1时的平均反应速率v(X)=$\frac{0.2}{{t}_{1}}$mol/(L•min) | |
| B. | 该温度下此反应的平衡常数K=0.32 | |
| C. | 欲提高平衡体系中Y的含量,可升高体系温度或减少Z的量 | |
| D. | 其他条件不变,再充入0.1 mol 气体X,平衡正向移动,X的转化率增大 |
分析 A.在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算P为0.7KPa时,反应掉X的物质的量,结合v=$\frac{△c}{△t}$计算;
B.在恒容容器中,气体的压强之比等于物质的量之比,利用三段式法计算平衡状态时即P为0.9KPa时各物质的浓度,以此计算K;
C.升温平衡逆向移动;
D.恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低.
解答 解:A.设反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
0.7KPa量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有$\frac{0.1-x+x+x}{0.1}$=$\frac{0.7}{0.5}$,x=0.04,所以v(X)=$\frac{\frac{0.04mol}{1.0L}}{{t}_{1}}$mol/(L•s)=$\frac{0.04}{{t}_{1}}$mol/(L•s),故A错误;
B.设反应的X物质的量为x,
X(g)?Y(g)+Z(g)
起始量(mol) 0.10 0 0
转化量(mol) x x x
平衡量(mol)0.10-x x x
在恒容容器中,气体的压强之比等于物质的量之比,有$\frac{0.1-x+x+x}{0.1}$=$\frac{0.9}{0.5}$,x=0.08,容器体积为1.0L,所以K=$\frac{0.08×0.08}{0.1-0.08}$=0.32,故B正确;
C.升温平衡逆向移动,Y含量减小,故C错误;
D.恒容容器中,平衡时再充入X,平衡正向移动,但正反应为气体体积增大的反应,X转化率降低,故D错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、K 的计算及平衡移动为解答的关键,侧重分析与应用能力的考查,注意物质的量与压强的关系,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 任意比 |
| 实验目的 | 试剂(或条件) | |
| A | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
| B | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉 ②铁钉 |
| C | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水 ②蒸馏所得液体 |
| D | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇 ②煤油 |

| A. | A | B. | B | C. | C | D. | D |
| A. | AlCl3和 NaOH | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和 H2SO4 | D. | Na2CO3和盐酸 |
| A. | 1L1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 标准状况下,22.4LSO3所含分子数为NA | |
| C. | 1mol 过氧化钠中阴离子所带电荷数为2NA | |
| D. | 0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | 0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3:1 | |
| D. | 25℃时,浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液的pH=4.75,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| A. | 稀硫酸 | B. | 蔗糖 | C. | CuSO4•5H2O | D. | NaCl固体 |
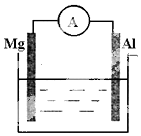 如图所示装置:
如图所示装置: