题目内容
15.相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,则同温同体积同浓度的HCN和HClO说法正确的是( )| A. | 电离程度:HCN>HClO | |
| B. | pH:HClO>HCN | |
| C. | 酸根离子浓度:c(CN-)<c(ClO-) | |
| D. | 与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO>HCN |
分析 相同物质的量浓度的NaCN和NaClO相比,NaCN溶液的pH较大,可知酸性HClO>HCN,酸性越强,电离程度越大,等浓度时电离出离子浓度大,以此来解答.
解答 解:A.酸性HClO>HCN,则电离程度为HClO>HCN,故A错误;
B.同浓度的HCN和HClO,酸性HClO>HCN,HClO电离出氢离子浓度大,则pH小,故B错误;
C.同浓度的HCN和HClO,酸性HClO>HCN,HClO电离程度大,则酸根离子浓度:c(CN-)<c(ClO-),故C正确;
D.同体积同浓度的HCN和HClO,物质的量相同,与NaOH溶液恰好完全反应时,消耗NaOH的物质的量:HClO=HCN,故D错误;
故选C.
点评 本题考查盐类水解,为高频考点,把握水解应用、酸性比较为解答的关键,侧重分析与应用能力的考查,注意盐中对应酸的酸性越弱、水解程度越大,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1L1mol/L的HCl溶液中所含氯化氢分子数为NA | |
| B. | 标准状况下,22.4LSO3所含分子数为NA | |
| C. | 1mol 过氧化钠中阴离子所带电荷数为2NA | |
| D. | 0.1molCl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA |
20.下列各组物质,按化合物、单质、混合物的顺序排列的是( )
| A. | 烧碱、液态氧、碘酒 | B. | 硫磺、白磷、小苏打 | ||
| C. | 干冰、铁、氯化氢 | D. | 空气、氮气、氯水 |
7.下列各溶液中,微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L NH4Cl溶液:c(NH4+ )=c(Cl-) | |
| B. | 0.1 mol/L NaHCO3溶液:c(OH-)+c(CO32-)=c(H+)+c(H2CO3) | |
| C. | 0.3mol/L和0.1mol/L的两醋酸溶液中H+离子浓度之比为3:1 | |
| D. | 25℃时,浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液的pH=4.75,则c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
4.足量铁粉与一定量的盐酸反应,为了减慢反应速率,但不减少氢气的产量,可加入下列物质中的( )
| A. | 水 | B. | NaOH固体 | C. | Na2CO3固体 | D. | NaNO3溶液 |
5.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18 g H2O含有10NA个质子 | |
| B. | 7.8 g Na2O2中含有的阴离子数是0.2NA | |
| C. | 标准状况下,22.4 L氨水含有NA个NH3分子 | |
| D. | 56 g铁片投入足量浓H2SO4中生成NA个SO2分子 |
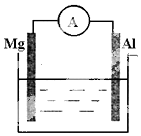 如图所示装置:
如图所示装置: