题目内容
16.下列属于吸热反应的是( )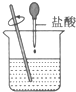 氢氧化钠溶液 | 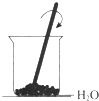 Ba(OH)2+H2O+NH4Cl | 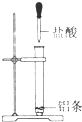 | 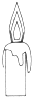 蜡烛燃烧 |
| A | B | C | D |
| A. | A | B. | B | C. | C | D. | D |
分析 常见的放热反应有:所有的物质燃烧、所有金属与酸或与水、所有中和反应、绝大多数化合反应、铝热反应;
常见的吸热反应有:绝大数分解反应、个别的化合反应(如C和CO2)、工业制水煤气、碳(一氧化碳、氢气)还原金属氧化物、某些复分解(如铵盐和强碱).
解答 解:A、酸碱中和为放热反应,故盐酸和氢氧化钠的反应为放热反应,故A错误;
B、铵盐和强碱的反应为吸热反应,故Ba(OH)2•8H2O和NH4Cl的反应吸热,故B正确;
C、金属和盐酸的反应为放热反应,故铝条和盐酸的反应为放热反应,故C错误;
D、物质的燃烧一定为放热反应,故蜡烛的燃烧放热,故D错误.
故选B.
点评 本题考查化学反应中能量变化,题目难度不大,掌握常见的放热反应和吸热反应是解题的关键.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
18.下列各组离子在碱性溶液中能够大量共存的是( )
| A. | Mg2+、Na+、Cl-、SO42- | B. | K+、Na+、Cl-、AlO2- | ||
| C. | Cu2+、Ca2+、Br-、I- | D. | Ba2+、K+、Cl-、HCO3- |
11.已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用下图装置进行中和热的测定,请回答下列问题:
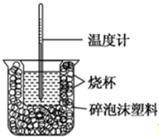
(1)该图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖.
(2)做一次完整的中和热测定实验,温度计需使用3次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
①比较△H1和△H2的相对大小:△H1<△H2(填“>”“<”或“=”).
②两组实验结果差异的原因是NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少.
③写出HCl和NH3•H2O反应的热化学方程式:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.

(1)该图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖.
(2)做一次完整的中和热测定实验,温度计需使用3次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
②两组实验结果差异的原因是NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少.
③写出HCl和NH3•H2O反应的热化学方程式:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.
1. 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
(1)卡片中记录合理的是③④⑥(填序号).
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
 如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
如图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:| ①Zn为正极,Cu为负极; ②H+向负极移动; ③Cu极有H2产生; ④电子流动方向Zn→G→Cu; ⑤正极的电极反应式是Zn-2e-=Zn2+: ⑥若有1mol电子流过导线,则理论上产生0.5mol H2. |
(2)该电池总反应的离子方程式是Zn+2H+=Zn2++H2↑.
(3)在实验中铜片上有气泡产生原因是锌较活泼,在负极发生氧化反应失去电子,电子由导线流向铜电极,氢离子在铜表面得到电子生成氢气.
(4)若将稀硫酸换成硫酸铜溶液,电极质量增加的是铜极(填“锌极”或“铜极”),原因是Cu2++2e-=Cu(用电极方程式表示).
8.如图装置放置一段时间后,铁钉均被腐蚀.下列有关描述错误的是( )
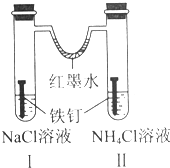

| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | Ⅰ和Ⅱ中负极反应式均为Fe-2e-=Fe2+ | |
| C. | Ⅰ中正极反应式为O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀 |
5.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到7.8g沉淀 | |
| C. | 最终得到的溶液中只含NaCl溶质 | |
| D. | 最终得到的溶液中c(Na+)=1.5mol/L |
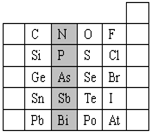 元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.如图是元素周期表的一部分.