题目内容
5.将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )| A. | 标准状况下,反应过程中得到6.72L的气体 | |
| B. | 最终得到7.8g沉淀 | |
| C. | 最终得到的溶液中只含NaCl溶质 | |
| D. | 最终得到的溶液中c(Na+)=1.5mol/L |
分析 15.6gNa2O2的物质的量为:$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为$\frac{5.4g}{27g/mol}$=0.2mol,首先发生反应2Na2O2+2H2O═4NaOH+O2↑,生成NaOH为0.4mol,再发生2Al+2NaOH+2H2O═2NaAlO2+3H2↑,由方程式可知Al完全反应,剩余NaOH为0.4mol-0.2mol=0.2mol,生成NaAlO2为0.2mol,通入标准状况下的HCl气体6.72L,物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,首先发生反应NaOH+HCl═NaCl+H2O,剩余HCl为0.3mol-0.2mol=0.1mol,再发生反应NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,由方程式可知,NaAlO2有剩余,HCl完全反应,生成Al(OH)3为0.1mol,最终溶液中溶质为NaAlO2、NaCl,据此减小解答.
解答 解:15.6gNa2O2的物质的量为:n(Na2O2)=$\frac{15.6g}{78g/mol}$=0.2mol,5.4gAl的物质的量为:n(Al)=$\frac{5.4g}{27g/mol}$=0.2mol,则:
首先:2Na2O2+2H2O═4NaOH+O2↑
0.2mol 0.4mol 2.24L
然后:2Al+2H2O+2NaOH═2NaAlO2+3H2↑
0.2mol 0.2mol 0.2mol 6.72L
则剩余NaOH的物质的量为:0.4mol-0.2mol=0.2mol,生成NaAlO2的物质的量为0.2mol,生成O2的体积为2.24L、H2为6.72L;
向溶液中通入标准状况下的HCl气体6.72L,物质的量为:n(HCl)=$\frac{6.72L}{22.4L/mol}$=0.3mol,则:
HCl+NaOH═NaCl+H2O
0.2mol 0.2mol 0.2mol
剩余HCl为:0.3mol-0.2mol=0.1mol,生成0.2molNaCl,
NaAlO2+HCl+H2O═Al(OH)3↓+NaCl,
0.1mol 0.1mol 0.1mol 0.1mol
故NaAlO2有剩余,HCl完全反应,剩余NaAlO2为0.2mol-0.1mol=0.1mol,生成Al(OH)3为0.1mol、NaCl为0.1mol,反应后溶液中含有0.3molNaCl、0.1molNaAlO2,
A.生成O2为2.24L、H2为6.72L,故生成气体总体积为2.24L+6.72L=8.96L,故A错误;
B.最终生成Al(OH)3为0.1mol,质量为0.1mol×78g/mol=7.8g,故B正确;
C.反应后生成了0.3molNaCl,最终还剩余0.1molNaAlO2,最终溶液中溶质为NaAlO2、NaCl,故C错误;
D.根据钠离子守恒可知,反应后溶液中n(Na+)=2n(Na2O2)=2×0.2mol=0.4mol,则最终溶液中钠离子浓度为:c(Na+)=$\frac{0.4mol}{0.2L}$=2mol/L,故D错误;
故选B.
点评 本题考查化学方程式的计算、混合物的计算、钠的化合物与铝单质及化合物的性质等知识,题目难度较大,根据过量计算判断发生的反应是解题的关键,试题有利于提高学生的化学计算能力.

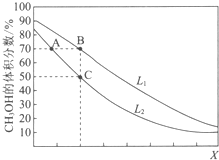 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )| A. | X代表压强 | B. | L1<L2 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量的变化.
| A. | 只有① | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
| A. | R一定是非金属元素 | B. | R的最高价氧化物为R2O5 | ||
| C. | 最高价氧化物对应水化物H2RO4 | D. | R的气态氢化物为RH5 |
| A. | 参加反应的Zn质量一定相等 | B. | 硫酸反应完全,CH3COOH有剩余 | ||
| C. | 两种酸都有剩余 | D. | 参加反应的Zn的质量比为3:4 |
| A. | 5%葡萄糖溶液 | B. | 0.9%氯化钠溶液 | ||
| C. | 1.25%碳酸氢钠溶液 | D. | 0.9%氯化铵溶液 |
| A. | Na2CO3和HCl | B. | NaHSO4和Ba(OH)2 | C. | NaAlO2和H2SO4 | D. | AlCl3和NH3•H2O |