题目内容
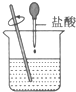
8.如图装置放置一段时间后,铁钉均被腐蚀.下列有关描述错误的是( )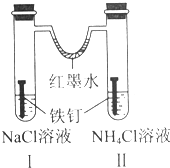
| A. | 红墨水水柱两边的液面变为左低右高 | |
| B. | Ⅰ和Ⅱ中负极反应式均为Fe-2e-=Fe2+ | |
| C. | Ⅰ中正极反应式为O2+2H2O+4e-=4OH- | |
| D. | Ⅱ中加入少量K3[Fe(CN)6]溶液,生成蓝色沉淀 |
分析 生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应;左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀.
解答 解:A.左边试管中是中性溶液,发生吸氧腐蚀,右边试管中是酸性溶液发生析氢腐蚀,所以左边试管内气体的氧气减小,右边试管内气体的压强不大,导致U型管内红墨水左高右低,故A错误;
B.生铁的吸氧腐蚀和析氢腐蚀中都是铁作负极,负极上铁失电子发生氧化反应Fe-2e-=Fe2+,故B正确;
C.I中正极反应方程式是:O2+2H2O+4e-═4OH-,故C正确;
D.Ⅱ中负极上生成亚铁离子,加K3[Fe(CN)6]溶液,生成蓝色沉淀,故D正确.
故选A.
点评 本题考查了金属的腐蚀与防护,题目难度不大,明确生铁在中性溶液中易发生吸氧腐蚀,在酸性溶液中易发生析氢腐蚀.

练习册系列答案
相关题目
9.下列有关物质性质的叙述正确的是( )
| A. | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀,说明结合H+的能力:AlO2->CO32- | |
| B. | 将SO2通入含HClO的溶液中生成H2SO4,说明酸性:HClO>H2SO4 | |
| C. | 浓、稀硝酸与Cu反应的产物分别是NO2和NO,说明氧化性:稀硝酸>浓硝酸 | |
| D. | 高温时C能置换出SiO2中的Si,说明还原性:C>Si |
10.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,26gC2H2和C6H6的混合物所含原子数为4NA | |
| B. | 标准状况下,11.2LH2O中所含O-H键数目为NA | |
| C. | 1molCl2与足量Fe在点燃条件下发生反应,转移电子数为3NA | |
| D. | 常温下,pH=13的NaOH溶液,OH-离子的数目为0.1NA |
3.在电解水制取H2和O2时,为了增强液体的导电性,可加入下列物质中的( )
| A. | HCl | B. | CuCl2 | C. | NaOH | D. | CuSO4 |
13.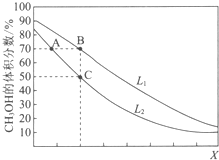 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )| A. | X代表压强 | B. | L1<L2 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
20.下列叙述正确的是( )
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量的变化.
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量的变化.
| A. | 只有① | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
17.各为50mL的H2SO4和CH3COOH两种溶液中,测得c(H+)都等于0.2mol/L.向两份酸中各加入Zn粉,结果产生H2的体积比为3:4,下列说法中,一定正确的是( )
| A. | 参加反应的Zn质量一定相等 | B. | 硫酸反应完全,CH3COOH有剩余 | ||
| C. | 两种酸都有剩余 | D. | 参加反应的Zn的质量比为3:4 |
18.将56g铁粉和16g硫粉隔绝空气加热,使其充分反应并冷却后,再加入适量盐酸,最后可得气体体积为(标准状况)( )
| A. | 5.6L | B. | 11.2L | C. | 22.4L | D. | 44.8L |