题目内容
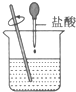
11.已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热.现利用下图装置进行中和热的测定,请回答下列问题: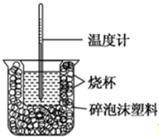
(1)该图中有两处未画出,它们分别是环形玻璃搅拌棒、烧杯上方的泡沫塑料盖.
(2)做一次完整的中和热测定实验,温度计需使用3次.
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g•℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
| 反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
| HCl+NaOH | 13 | 19.8 | △H1 |
| HCl+NH3•H2O | 13 | 19.3 | △H2 |
②两组实验结果差异的原因是NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少.
③写出HCl和NH3•H2O反应的热化学方程式:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.
分析 (1)根据量热计的构造来判断该装置的缺少的部分;
(2)中和热的测定中,需要测出反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度;
(3)①②根据弱电解质电离需要吸收热量;
③先根据公式Q=cm△T来求出生成0.025mol的水放出热量,然后写出热化学方程式.
解答 解:(1)由量热计的构造可知该装置的缺少仪器是环形玻璃搅拌棒和烧杯上方的泡沫塑料盖;
故答案为:环形玻璃搅拌棒;烧杯上方的泡沫塑料盖;
(2)中和热的测定中,需要测出反应前酸溶液的温度,测反应前碱溶液的温度,混合反应后测最高温度,所以总共需要测量3次;
故答案为:3;
(3)NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少,但中和热偏大;
故答案为:①<;②NH3•H2O是弱碱,因为中和过程中发生电离要吸热,因而放热较少;
③浓度为1.0mol/L的HCl溶液和1.1mol/L的NH3•H2O溶液各50mL混合,反应生成了0.05mol水,混合后溶液的质量m=100mL×1g/mL=100g,c=4.18J/(g•℃),代入公式Q=cm△T得生成0.05mol的水放出热量Q=4.18J/(g•℃)×100g×6.3℃=2.6334kJ,即生成0.05mol的水放出热量2.6334kJ,所以生成1mol的水放出热量为2.6334kJ×$\frac{1mol}{0.05mol}$=52.7kJ,热化学方程式为:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol;
故答案为:HCl(aq)+NH3•H2O(aq)=NH4Cl(aq)+H2O(l)△H=-52.7KJ/mol.
点评 本题考查了中和热的测定,明确中和热的定义和测量中和热的原理是解题关键,注意实验操作过程中关键在于尽可能减少热量散失,测定结果才能准确.

| A. | 石灰石溶于盐酸:CaCO3+2 H+→Ca2++H2O+CO2↑ | |
| B. | 氯水滴加到碘化钾溶液中:Cl2+I-→I2+Cl- | |
| C. | 铁和硫酸铜溶液反应:Fe+Cu2+→Fe2++Cu | |
| D. | 醋酸溶液和氢氧化钾溶液混合:CH3COOH+OH-→CH3COO-+H2O |
| A. | CO(g)+$\frac{1}{2}$O2(g)═CO2(g);△H=-283.0 kJ/mol | |
| B. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H=-110.5 kJ/mol | |
| C. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=-11 036 kJ/mol |
| A. | 常温常压下,26gC2H2和C6H6的混合物所含原子数为4NA | |
| B. | 标准状况下,11.2LH2O中所含O-H键数目为NA | |
| C. | 1molCl2与足量Fe在点燃条件下发生反应,转移电子数为3NA | |
| D. | 常温下,pH=13的NaOH溶液,OH-离子的数目为0.1NA |
 如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )
如图,将锥形瓶置于水槽内,瓶中加入酒精.水槽中加入冷水后,再加入足量的下列物质,结果产生了酒精喷泉.水槽中加入的物质可以是( )| A. | 生石灰 | B. | 食盐 | C. | 蔗糖 | D. | 固体NH4NO3 |
| A. | HCl | B. | CuCl2 | C. | NaOH | D. | CuSO4 |
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量的变化.
| A. | 只有① | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |