题目内容
4.工业上可以由N2和H2在高温高压以及催化剂的条件下合成NH3,已知该反应为放热反应.(1)写出该反应的化学方程式3H2+N2$\stackrel{高温高压催化剂}{?}$2NH3.已知:1molN2的共价键断裂吸收的能量为Q1kJ; 1molH2的化学键断裂吸收的能量为Q2kJ;形成1molNH3中的化学键释放的能量为Q3kJ.则Q1+3Q2<2Q3 (填“>”、“<”或“=”).
(2)写出加快合成氨反应速率的两条措施升高温度、增加反应物的浓度
(3)工业上也可通过电解的方法由N2制取NH3:2N2+6H2O$\frac{\underline{\;电解\;}}{\;}$4NH3+3O2,若制得8.96L(标准状况下)NH3,需要N25.6g.
分析 (1)氮气和氢气在高温高压催化剂的作用下发生反应得到氨气;放热反应新化学键生成释放的能量高于就见断裂吸收的能量;
(2)升高温度,增加压强、加催化剂、增加反应物浓度都可以加快反应速率;
(3)根据化学方程式进行计算.
解答 解:(1)工业上可以由N2和H2在高温高压以及催化剂的条件下合成NH3,即3H2+N2$\stackrel{高温高压催化剂}{?}$2NH3,1molN2的共价键断裂吸收的能量为Q1kJ; 1molH2的化学键断裂吸收的能量为Q2kJ;形成1molNH3中的化学键释放的能量为Q3kJ,该反应是放热反应,所以新化学键生成释放的能量高于就见断裂吸收的能量,即Q1+3Q2<2Q3,故答案为:3H2+N2$\stackrel{高温高压催化剂}{?}$2NH3;<;
(2)升高温度,增加压强、加催化剂、增加反应物浓度都可以加快反应速率,故答案为:升高温度;增加反应物浓度(加催化剂、增加压强);
(3)若制得8.96L即0.4mol(标准状况下)NH3,需要N20.2mol,质量是0.2mol×28g/mol=5.6g,故答案为:5.6.
点评 本题综合考查化学平衡移动问题,为高考常见题型,侧重于考查学生的分析能力,本题可从压强对平衡移动影响的角度分析,难度中等.

练习册系列答案
相关题目
5.下列有关化学实验的操作或说法中,正确的是( )
| A. | 甘油、油脂均能使酸性KMnO4溶液褪色 | |
| B. | 检验C2H5Cl中氯原子时,将C2H5Cl和NaOH溶液混合加热后,加入稀硝酸进行酸化,再加硝酸银溶液,观察现象 | |
| C. | 淀粉水解程度的检验要用到的试剂有:碘水、氢氧化钠、新制氢氧化铜 | |
| D. | 制溴苯应用液溴、铁屑和苯混合,反应中可观察到容器中有大量白色雾气 |
3.NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 标准状况下,22.4L N2和H2的混合气中含NA个原子 | |
| C. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 标准状况下,22.4L氨水含有NA个NH3分子 |
10.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 常温常压下,26gC2H2和C6H6的混合物所含原子数为4NA | |
| B. | 标准状况下,11.2LH2O中所含O-H键数目为NA | |
| C. | 1molCl2与足量Fe在点燃条件下发生反应,转移电子数为3NA | |
| D. | 常温下,pH=13的NaOH溶液,OH-离子的数目为0.1NA |
9.在反应X+2Y=R+2M中,当32gY与X恰好完全反应后,生成18gM,且生成的R和M的质量比为11:9,则在此反应中,参加反应的X与生成的R的质量比为( )
| A. | 4:11 | B. | 16:9 | C. | 8:11 | D. | 32:9 |
13.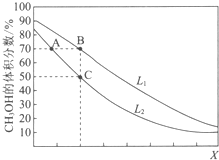 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
 向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )
向密闭容器中,按n(CO):n(H2)=1:2充入反应物,发生反应:CO(g)+2H2(g)?CH3OH(g)△H<0.L(L1、L2)、X可分别代表压强或温度,如图表示L一定时,平衡混合物中CH3OH的体积分数随X的变化关系.下列说法中,正确的是( )| A. | X代表压强 | B. | L1<L2 | ||
| C. | 平衡常数:K(A)=K(B) | D. | 在C点时,CO转化率为75% |
14.在医院中,为酸中毒病人输液不应采用( )
| A. | 5%葡萄糖溶液 | B. | 0.9%氯化钠溶液 | ||
| C. | 1.25%碳酸氢钠溶液 | D. | 0.9%氯化铵溶液 |