��Ŀ����
����ݻ�ѧѧ���еĻ������ۣ��ش���������
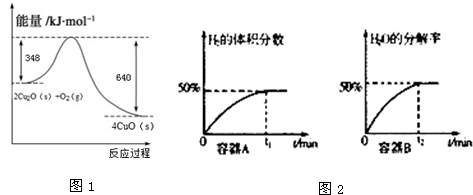
��1��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�������ԭCuO���Ƶ�Cu2O����֪��1��C��s��ȼ��ȫ������COʱ�ų�����9.2kJ��Cu2O��s����O2��g����Ӧ�������仯��ͼ1��ʾ����д��������̿�ۻ�ԭCuO��s���Ʊ�Cu2O��s�����Ȼ�ѧ����ʽ
��2���ڼ�����������Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ����N2��H2O���÷�Ӧ�Ļ�ѧ����ʽΪ ��������N211.2L���ѻ���Ϊ��״����ʱ�����Ʊ�����Cu2O������Ϊ
��3��ij��ȤС��ͬѧ������Cu2O�����ˮ������̽����������Ի�ѧƽ���Ӱ�죮
���������Ϊ1L���¶ȷֱ�ΪT1��T2��A��B���ܱ������ж���������Cu2O��ͨ��0.1molˮ������������Ӧ��2H2O��g��?2H2��g��+O2��g����H=+484kJ?mol-1���ⶨA��B�������ڷ�Ӧ�����з�����ͼ2��ʾ�仯����A��B��������Ӧ���¶�T1 T2 �����������=�����������ù�����A����������Ҫ�������� kJ
�ڵ��÷�Ӧ����ƽ��״̬ʱ�����м�������Ӧ���ʣ���������H2O��g���ֽ��ʵĴ�ʩ�ǣ�����ţ� ��
A����ƽ�������г���Ar B�����߷�Ӧ���¶�
C������Ӧ��ϵ��ѹǿ D����ƽ�������г���O2
��4��25��ʱ��H2SO3�THSO3-+H+�ĵ��볣��Ka=1��10-2mol/L������¶���NaHSO3��ˮ��ƽ�ⳣ��Kh= mol/L��

��1��������Cu2O����Ϊ̫����ֽ�ˮ�Ĵ�������ԭCuO���Ƶ�Cu2O����֪��1��C��s��ȼ��ȫ������COʱ�ų�����9.2kJ��Cu2O��s����O2��g����Ӧ�������仯��ͼ1��ʾ����д��������̿�ۻ�ԭCuO��s���Ʊ�Cu2O��s�����Ȼ�ѧ����ʽ
��2���ڼ�����������Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ����N2��H2O���÷�Ӧ�Ļ�ѧ����ʽΪ
��3��ij��ȤС��ͬѧ������Cu2O�����ˮ������̽����������Ի�ѧƽ���Ӱ�죮
���������Ϊ1L���¶ȷֱ�ΪT1��T2��A��B���ܱ������ж���������Cu2O��ͨ��0.1molˮ������������Ӧ��2H2O��g��?2H2��g��+O2��g����H=+484kJ?mol-1���ⶨA��B�������ڷ�Ӧ�����з�����ͼ2��ʾ�仯����A��B��������Ӧ���¶�T1
�ڵ��÷�Ӧ����ƽ��״̬ʱ�����м�������Ӧ���ʣ���������H2O��g���ֽ��ʵĴ�ʩ�ǣ�����ţ�
A����ƽ�������г���Ar B�����߷�Ӧ���¶�
C������Ӧ��ϵ��ѹǿ D����ƽ�������г���O2
��4��25��ʱ��H2SO3�THSO3-+H+�ĵ��볣��Ka=1��10-2mol/L������¶���NaHSO3��ˮ��ƽ�ⳣ��Kh=
���㣺�Ȼ�ѧ����ʽ,��ѧƽ���Ӱ������,��ѧƽ��ĵ�������,��ѧƽ��ļ���
ר�⣺�����������������
��������1������ͼ�����Ȼ�ѧ����ʽ��˹���ɽ��
��2��Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ����N2��H2O������ԭ���غ���д��ѧ����ʽ�����ݵ���ת����Ŀ�غ���㣻
��3�������ݻ�ѧ����ʽ���ͼ����t1�������������������
�ڼ�������Ӧ���ʣ���������H2O��g���ֽ��ʵ�����Ϊ���£���ѹ������ƽ���ƶ�ԭ�������жϣ�
��4��Ka=
��HSO3-+H2O�TH2SO3+OH-��Kb=
=1.0��102��1.0��10-14=1.0��10-12��
��2��Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ����N2��H2O������ԭ���غ���д��ѧ����ʽ�����ݵ���ת����Ŀ�غ���㣻
��3�������ݻ�ѧ����ʽ���ͼ����t1�������������������
�ڼ�������Ӧ���ʣ���������H2O��g���ֽ��ʵ�����Ϊ���£���ѹ������ƽ���ƶ�ԭ�������жϣ�
��4��Ka=
| c(HSO3-)c(H+) |
| c(H2SO3) |
| c(H2SO3)Kw |
| c(HSO3-)c(H+) |
���
�⣺��1����֪��1g C��s��ȼ��ȫ������COʱ�ų�����9.2kJ��24gCȼ������һ����̼����220.8KJ���Ȼ�ѧ����ʽΪ��2C��s��+O2��g��=2CO��g����H=-220.8kJ?mol-1������ͼ����д�Ȼ�ѧ����ʽ2Cu2O��s��+O2��g��=4CuO��s����H=-292kJ?mol-1��
��2Cu2O��s��+O2��g��=4CuO��s����H=-292kJ?mol-1
��2C��s��+O2��g��=2CO��g����H=-220.8kJ?mol-1
���ݸ�˹���ɣ���-�ٵ�4CuO��s��+2C��s��=2CO��g��+2Cu2O��s������H=+71kJ?mol-1
��2CuO��s��+C��s��=CO��g��+Cu2O��s������H=+35.6kJ?mol-1
�ʴ�Ϊ��2CuO��s��+C��s��=CO��g��+Cu2O��s����H=+35.6kJ?mol-1��
��2����Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ����N2��H2O����Ӧ�Ļ�ѧ����ʽΪ��4Cu��OH��2+N2H4=2Cu2O+N2+6H2O�������ɵ�Cu2O�����ʵ���Ϊnmol�����ݵ���ת����Ŀ�غ㣬����
nmol��2����1-0��=
��2��[0-��-2��]�����n=1mol��
���Կ��Ʊ�Cu2O������Ϊ1mol��144g/mol=144g��
�ʴ�Ϊ��4Cu��OH��2+N2H4=2Cu2O+N2+6H2O��144g��
��3�������ݻ�ѧ����ʽ���㣻����ͼ���������ٷֺ���Ϊ50%���跴Ӧ��ˮ�����ʵ���Ϊx
2H2O��g��
2H2��g��+O2 ��H=484kJ?mol-1
2mol 484KJ
x x 0.5x
=50%��
����õ�x=
mol����Ӧ����=
=16.1KJ��
ˮ�ķֽ���=
��100%=66��7%����T2�¶���ˮ�ķֽ���Ϊ50%����Ӧ�����ȷ�Ӧ���¶�Խ��ˮ�ķֽ���Խ������T1��T2��
�ʴ�Ϊ������16.1��
�ڼ�������Ӧ���ʣ���������H2O��g���ֽ��ʵ�����Ϊ���£���ѹ������ƽ���ƶ�ԭ�������жϣ�
A����ƽ�������г���Ar��������ϵѹǿ��ƽ��������У���A�����ϣ�
B����Ӧ�����ȷ�Ӧ�����߷�Ӧ���¶ȣ���Ӧ��������ƽ��������У�ˮ�ķֽ�������B���ϣ�
C����Ӧ�������������ķ�Ӧ������Ӧ��ϵ��ѹǿ��ƽ��������У���C�����ϣ�
D����ƽ�������г���O2��ƽ��������У���D�����ϣ�
�ʴ�Ϊ��B��
��4��25��ʱ��H2SO3�THSO3-+H+�ĵ��볣��Ka=1��10-2mol/L��Ka=
��HSO3-+H2O�TH2SO3+OH-��Kb=
=1.0��102��1.0��10-14=1.0��10-12��
����¶���NaHSO3��ˮ��ƽ�ⳣ��Kh=1.0��10-12��
�ʴ�Ϊ��1.0��10-12��
��2Cu2O��s��+O2��g��=4CuO��s����H=-292kJ?mol-1
��2C��s��+O2��g��=2CO��g����H=-220.8kJ?mol-1
���ݸ�˹���ɣ���-�ٵ�4CuO��s��+2C��s��=2CO��g��+2Cu2O��s������H=+71kJ?mol-1
��2CuO��s��+C��s��=CO��g��+Cu2O��s������H=+35.6kJ?mol-1
�ʴ�Ϊ��2CuO��s��+C��s��=CO��g��+Cu2O��s����H=+35.6kJ?mol-1��
��2����Һ̬�£�N2H4����ԭ����Cu��OH��2���Ʊ�����Cu2O��ͬʱ����N2��H2O����Ӧ�Ļ�ѧ����ʽΪ��4Cu��OH��2+N2H4=2Cu2O+N2+6H2O�������ɵ�Cu2O�����ʵ���Ϊnmol�����ݵ���ת����Ŀ�غ㣬����
nmol��2����1-0��=
| 11.2L |
| 22.4L/mol |
���Կ��Ʊ�Cu2O������Ϊ1mol��144g/mol=144g��
�ʴ�Ϊ��4Cu��OH��2+N2H4=2Cu2O+N2+6H2O��144g��
��3�������ݻ�ѧ����ʽ���㣻����ͼ���������ٷֺ���Ϊ50%���跴Ӧ��ˮ�����ʵ���Ϊx
2H2O��g��
| ||
| Cu2O |
2mol 484KJ
x x 0.5x
| x |
| 0.1mol-x+x+0.5x |
����õ�x=
| 1 |
| 15 |
| ||
| 2 |
ˮ�ķֽ���=
| ||
| 0.1 |
�ʴ�Ϊ������16.1��
�ڼ�������Ӧ���ʣ���������H2O��g���ֽ��ʵ�����Ϊ���£���ѹ������ƽ���ƶ�ԭ�������жϣ�
A����ƽ�������г���Ar��������ϵѹǿ��ƽ��������У���A�����ϣ�
B����Ӧ�����ȷ�Ӧ�����߷�Ӧ���¶ȣ���Ӧ��������ƽ��������У�ˮ�ķֽ�������B���ϣ�
C����Ӧ�������������ķ�Ӧ������Ӧ��ϵ��ѹǿ��ƽ��������У���C�����ϣ�
D����ƽ�������г���O2��ƽ��������У���D�����ϣ�
�ʴ�Ϊ��B��
��4��25��ʱ��H2SO3�THSO3-+H+�ĵ��볣��Ka=1��10-2mol/L��Ka=
| c(HSO3-)c(H+) |
| c(H2SO3) |
| c(H2SO3)Kw |
| c(HSO3-)c(H+) |
����¶���NaHSO3��ˮ��ƽ�ⳣ��Kh=1.0��10-12��
�ʴ�Ϊ��1.0��10-12��
���������⿼�����Ȼ�ѧ����ʽ����д������˹���ɵļ���Ӧ�ã���ѧƽ��Ӱ�����ط����жϣ�ˮ�ⳣ�������ƽ�ⳣ���ļ��㣬ע��ƽ�⽨������������Ӧ�ã���Ŀ�Ѷ��еȣ�

��ϰ��ϵ�д�
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
�����Ŀ
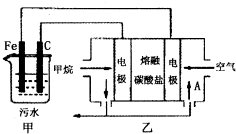 ��ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3��Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���ø�ԭ��������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ�������
��ҵ�ϲ��õ�һ����ˮ�����������£�������ˮ��pH��5.0��6.0֮�䣬ͨ���������Fe��OH��3��Fe��OH��3���������ԣ�����������������������о���ˮ�����ã��������������ݰ���ˮ�����������ˮ���γɸ����㣬��ȥ����Ʋ���������㣬�����˸�ѡ���������ã�ij����С���ø�ԭ��������ˮ�����װ����ͼ��ʾ������˵����ȷ���ǣ�������| A��Ϊ��ʹ��ȼ�ϵ�س�ʱ���ȶ����У���صĵ�������Ӧ�����ȶ�����ع���ʱ��ѭ��������AΪCO2 |
| B����װ����Fe�缫�ķ�ӦΪFe-3e-=Fe3+ |
| C��Ϊ��������ˮ�ĵ���������Ӧ����ˮ������������H2SO4��Һ |
| D������װ������1.6g CH4�μӷ�Ӧ����C�缫���������������ڱ�״����Ϊ4.48L |
����˵����ȷ���ǣ���ֲ���ͺ��ѻ����Ͷ�����ʹ��ˮ��ɫ�������ࡢ��֬�͵����ʶ��ܷ���ˮ�ⷴӦ���۵�������Һ�м���Ũ���������Һ���г����������ܷ������������ֿ�����ʳƷ���ʼ������Ҵ������ᡢ�����������ܷ���ȡ����Ӧ�������͡����ͺͻ����Ͷ��ǻ����̶��ķе㣬ֻ�л�������������������Һ��Ӧ��������
| A���٢ۢ� | B���٢ڢ� |
| C���ڢܢ� | D���ڢۢ� |
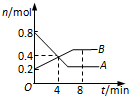 ij�¶�ʱ����2L�ܱ�������ijһ��Ӧ��A��B���ʵ�����ʱ��仯��������ͼ��ʾ������˵������ȷ���ǣ�������
ij�¶�ʱ����2L�ܱ�������ijһ��Ӧ��A��B���ʵ�����ʱ��仯��������ͼ��ʾ������˵������ȷ���ǣ�������| A���÷�Ӧ�Ļ�ѧ����ʽΪ��2A��B |
| B����Ӧ��ʼ��4 minʱ��A��ƽ����Ӧ����Ϊ0.05 mol/��L?min�� |
| C��4 minʱ�������淴Ӧ���ʵĴ�С��ϵΪ��v��������v���棩 |
| D��8 minʱ�������淴Ӧ���ʵĴ�С��ϵΪ��v��������v���棩 |
21���ͻ�ѧ�����¶���Ϊ����ѧ��һ�Ŵ��������ʵĿ�ѧ���������й�˵������ȷ���ǣ�������
| A�������˹���ϳɷ�Ӧ��̽����������̼ת��Ϊ̼�⻯������ȼ�ϣ����ڵ�̼���� |
| B��������ȫ����Ч���Ͷ����Ͳ���������ũҩ |
| C���Ӵ�ϡ����Դ�Ŀ��ɺͳ��ڣ����������²�Ʒ����֤���ÿ��ٷ�չ |
| D���Ʊ�����ʱ̽����ѧ��Ӧ�и�ѡ���ԡ�ת���ʺ�ԭ�������ʣ����ڡ���ɫ������������ |
����˵����ȷ���ǣ�������
| A����ˮ�м�ˮϡ�ͺ���Һ�г���H2O������������Ũ�ȶ��½� |
| B����NaHC2O4��Һ��pH=5������Һ��c��C2O42-����c��H2C2O4�� |
| C��pH��ͬ�Ĵ�����Һ�����ᣬ�ֱ�������ˮϡ����ԭ��Һ�����m����n������ϡ�ͺ�����Һ��pH����ͬ����m��n |
| D�������£�pH=4���Ȼ����Һ��pH=4��ϡ�����У���ˮ�������c��H+��֮��Ϊ106��1 |
�����й�ʵ��ԭ���������ͽ��۶���ȷ���ǣ�������
| A������ˮ�е���ֲ���ͣ����Ͳ�����ɫ��˵���岻������֬ |
| B��������Һ�м�������ͭ��Һ�����õ��ij�������������ټ�ˮ�������ܽ� |
| C��pH��Ϊ3����HA��HB�ֱ�������Mg��Ӧ��HA�ų���H2�࣬˵������HA��HB |
| D��������ϡ�����������ˮ�������������ʹ��Һ�ʼ��ԣ��ټ�������Cu��OH��2����ȣ�����ש��ɫ�������ɣ�������Ѿ���ʼˮ�� |
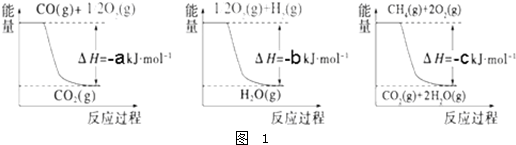
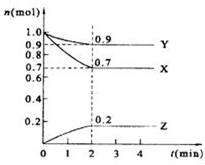 ij�¶�ʱ����2L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ��
ij�¶�ʱ����2L���ܱ������У�X��Y��Z�������ʵ�����ʱ��ı仯������ͼ��ʾ��