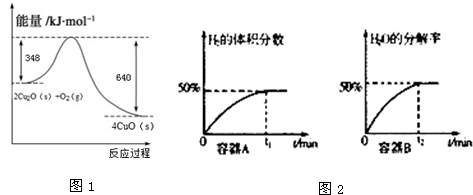
题目内容
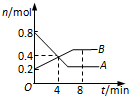 某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )
某温度时,在2L密闭容器中某一反应的A、B物质的量随时间变化的曲线如图所示.下列说法不正确的是( )| A、该反应的化学方程式为:2A→B |
| B、反应开始至4 min时,A的平均反应速率为0.05 mol/(L?min) |
| C、4 min时,正、逆反应速率的大小关系为:v(正)>v(逆) |
| D、8 min时,正、逆反应速率的大小关系为:v(正)<v(逆) |
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:A、结合图象,达到平衡时,A的物质的量为0.2mol,减小0.6mol,A为反应物,B的物质的量为0.5mol,增加了0.3mol,B为生成物,故反应的方程式为2A?B,以此解答该题;
B、利用v(A)=
计算得出;
C、根据A、B物质的量的变化判断反应进行的方向,据此判断;
D、根据平衡所处的状态判断.
B、利用v(A)=
| △c |
| △t |
C、根据A、B物质的量的变化判断反应进行的方向,据此判断;
D、根据平衡所处的状态判断.
解答:
解:A、结合图象,达到平衡时,A的物质的量为0.2mol,减小0.6mol,A为反应物,B的物质的量为0.5mol,增加了0.3mol,B为生成物,故反应的方程式为2A?B,故A正确;
B、用v(A)=
=
=0.05 mol/(L?min),故B正确;
C、4 min时,A物质的物质的量在减小,B特制的量在增加,反应正向进行,v(正)>v(逆),故C正确;
D、8 min时,A、B的物质的量都不再改变,反应达到平衡状态,v(正)=v(逆),故D错误;
故选D.
B、用v(A)=
| △c |
| △t |
| ||
| 4 min |
C、4 min时,A物质的物质的量在减小,B特制的量在增加,反应正向进行,v(正)>v(逆),故C正确;
D、8 min时,A、B的物质的量都不再改变,反应达到平衡状态,v(正)=v(逆),故D错误;
故选D.
点评:本题考查化学平衡中反应速率问题及根据图象写方程式,难度较小,注意把握图象曲线变化的趋势以及平衡状态的判断.

练习册系列答案
相关题目
下列说法正确的是( )
| A、科恩和渡普尔因理论化学方面的贡献获得化学界最高成就诺贝尔化学奖,标志着化学已成为以理论研究为主的学科 |
| B、PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重.因此由PM2.5引起的雾霾一定属于气溶胶 |
| C、对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油 |
| D、采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,以提高空气质量;推广可利用太阳能、风能等新能源,发展低碳经济,同时能大大减少对环境的污染 |
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合时,X电极附近溶液先变红.下列分析不正确的是( )


| A、A的金属活动性强于B |
| B、Y的电极反应:2Cl--2e-═Cl2↑ |
| C、阴离子交换膜处的SO42-从左向右移动 |
| D、当电路中有0.1mol电子通过时B电极有0.05mol金属析出 |
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,对人体健康或环境有很大影响 |
| B、同位素示踪法、分光光度法、核磁共振技术都是研究化学反应历程的重要手段 |
| C、垃圾焚烧不仅可以用于发电,还不会带来任何新污染 |
| D、地沟油的主要成分是高级脂肪酸甘油酯,故允许加工为食用油,也可用于制肥皂 |
常温下,铁与下列酸溶液作用产生H2的是( )
| A、硅酸 | B、浓硫酸 |
| C、稀盐酸 | D、稀硝酸 |
列关于①苯、②乙醇、③乙酸、④葡萄糖等有机物的叙述中,不正确的是( )
| A、可以用新制氢氧化铜鉴别③与④ |
| B、只有③能与金属钠反应 |
| C、①、②、③均能发生取代反应 |
| D、一定条件下,④可以转化为② |
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| B、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、向Ca(ClO)2溶液中通入过量的 SO2:C1O-+SO2+H2O═HClO+HSO3- |
| D、FeSO4酸性溶液中加H2O2:2Fe2++H2O2═2Fe3++2OH- |