题目内容
下列说法正确的是( )
| A、向氨水中加水稀释后,溶液中除了H2O以外其他粒子浓度都下降 |
| B、若NaHC2O4溶液的pH=5,则溶液中c(C2O42-)<c(H2C2O4) |
| C、pH相同的醋酸溶液和盐酸,分别用蒸馏水稀释至原溶液体积的m倍和n倍,若稀释后两溶液的pH仍相同,则m<n |
| D、室温下,pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比为106:1 |
考点:弱电解质在水溶液中的电离平衡,pH的简单计算
专题:电离平衡与溶液的pH专题
分析:A.加水稀释促进一水合氨电离,溶液中c(H+)增大;
B.若NaHC2O4溶液的pH=5,则HC2O4-电离程度大于水解程度;
C.加水稀释醋酸促进醋酸电离,pH相等的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释倍数大于盐酸;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
B.若NaHC2O4溶液的pH=5,则HC2O4-电离程度大于水解程度;
C.加水稀释醋酸促进醋酸电离,pH相等的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释倍数大于盐酸;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离.
解答:
解:A.加水稀释促进一水合氨电离,溶液中c(OH-)减小,温度不变水的离子积常数不变,溶液中c(H+)增大,故A错误;
B.若NaHC2O4溶液的pH=5,则HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故B错误;
C.加水稀释醋酸促进醋酸电离,pH相等的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释倍数大于盐酸,所以m>n,故C错误;
D.pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比分别为10-4 mol/L、10-10 mol/L,所以二者之比=10-4 mol/L:10-10 mol/L=106:1,故D正确;
故选D.
B.若NaHC2O4溶液的pH=5,则HC2O4-电离程度大于水解程度,则c(C2O42-)>c(H2C2O4),故B错误;
C.加水稀释醋酸促进醋酸电离,pH相等的醋酸和盐酸稀释后溶液的pH仍然相等,则醋酸稀释倍数大于盐酸,所以m>n,故C错误;
D.pH=4的氯化铵溶液与pH=4的稀盐酸中,由水电离出的c(H+)之比分别为10-4 mol/L、10-10 mol/L,所以二者之比=10-4 mol/L:10-10 mol/L=106:1,故D正确;
故选D.
点评:本题考查了弱电解质的电离和盐类水解,根据弱电解质及盐类水解特点来分析解答,C选项采用逆向思维的方法分析,D选项中注意酸中水电离出c(H+)的计算方法,为易错点.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合时,X电极附近溶液先变红.下列分析不正确的是( )


| A、A的金属活动性强于B |
| B、Y的电极反应:2Cl--2e-═Cl2↑ |
| C、阴离子交换膜处的SO42-从左向右移动 |
| D、当电路中有0.1mol电子通过时B电极有0.05mol金属析出 |
关于“植物油”的叙述错误的是( )
| A、属于酯类 |
| B、不含碳碳双键 |
| C、比水轻 |
| D、在碱和加热条件下能完全水解 |
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是( )
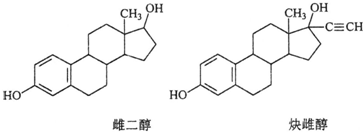

| A、核磁共振氢谱峰数相同 |
| B、均能发生加成反应、取代反应、消去反应 |
| C、两种分子中所有碳原子不可能在同一个平面内 |
| D、可用FeCl3溶液鉴别 |
下列说法正确的是( )


| A、装置甲不能防止铁钉生锈 |
| B、装置乙可除去乙烯中混有的乙炔 |
| C、装置丙可用于实验室制取乙酸乙酯 |
| D、装置丁可用于收集H2、CO2、Cl2、HCl、NO2等气体 |
下列表示对应化学反应的离子方程式正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
| B、Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O |
| C、向Ca(ClO)2溶液中通入过量的 SO2:C1O-+SO2+H2O═HClO+HSO3- |
| D、FeSO4酸性溶液中加H2O2:2Fe2++H2O2═2Fe3++2OH- |
如部分短周期元素原子半径与原子序数的关系图.则下列说法正确的是( )


| A、Y、R两种元素的气态氢化物及其最高价氧化物的水化物均为强酸 |
| B、简单离子的半径:X>Z>M |
| C、由X与N两种元素组成的化合物不能与任何酸反应,但能与强碱反应 |
| D、Z单质能从M与R元素构成的盐溶液中置换出单质M |