题目内容
氨的合成是最重要的化工生产之一.
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)
CO(g)+H2(g);
②用天然气跟水蒸气反应:CH4(g)+H2O(g)
CO(g)+3H2(g)
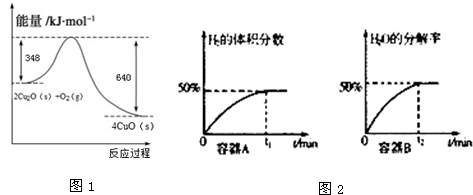
已知有关反应的能量变化如图1,且方法②的反应只能在高温下发生,则方法②中反应的△H= kJ/moL.
Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)
2NH3(g),按不同方式投入反应物,保持恒温、恒容,反应达到平衡时有关数据为:
(1)下列能说明该反应已达到平衡状态的是
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t 5min(填>、<或=)
(3)乙中从反应开始到平衡时N2的平均反应速率 (注明单位).
(4)分析上表数据,下列关系正确的是 .
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K= (用分数表示)(mol/L)-2.
(6)常温下NH4+(aq)+H2O(l)?NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol?L-1,则NH3?H2O的电离平衡常数K= (保留三位有效数字).已知草酸的电离常数为:Ka1=5.9×10-2 Ka2=6.4×10-5,则草酸氢铵的水溶液中离子浓度由大到小的顺序是: .
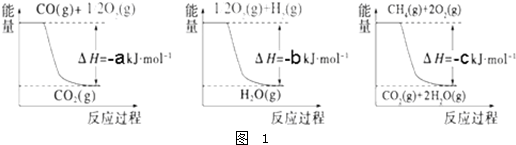
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示.电池正极的电极反应式是 ,A是 .
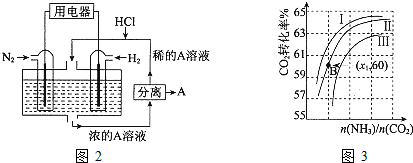
(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图3表示CO2的转化率与氨碳比
、水碳比
的变化关系.
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是 .
②测得B点氨的转化率为40%,则x1 .
Ⅰ.工业上合成氨用的H2有多种制取的方法:
①用焦炭跟水反应:C(s)+H2O(g)
| ||
②用天然气跟水蒸气反应:CH4(g)+H2O(g)
| ||
| 高温 |
已知有关反应的能量变化如图1,且方法②的反应只能在高温下发生,则方法②中反应的△H=

Ⅱ.在3个1L的密闭容器中,同温度下、使用相同催化剂分别进行反应:3H2(g)+N2(g)
| 高温高压 |
| 催化剂 |
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol?L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g?L-1) | ρ1 | ρ2 |
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.v(N2)正=3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(2)甲容器中达到平衡所需要的时间t
(3)乙中从反应开始到平衡时N2的平均反应速率
(4)分析上表数据,下列关系正确的是
a.2c1=3mol/L b.ω1=ω2 c. 2ρ1=ρ2
(5)该温度下,容器乙中,该反应的平衡常数K=
(6)常温下NH4+(aq)+H2O(l)?NH3?H2O(aq)+H+(aq)的化学平衡常数为5.55×10-10mol?L-1,则NH3?H2O的电离平衡常数K=
Ⅲ.(1)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图2所示.电池正极的电极反应式是

(2)用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g).工业生产时,原料气带有水蒸气.图3表示CO2的转化率与氨碳比
| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
①曲线Ⅰ、Ⅱ、Ⅲ对应的水碳比最大的是
②测得B点氨的转化率为40%,则x1
考点:化学平衡常数的含义,热化学方程式,原电池和电解池的工作原理,化学平衡状态的判断,转化率随温度、压强的变化曲线
专题:基本概念与基本理论
分析:Ⅰ.分别根据图1、图2、图3写出热化学方程式,然后根据盖斯定律来解答;
Ⅱ.(1)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断.
(2)甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长;
(3)先计算出用氮气表示的反应速率,然后利用化学计量数关系计算出用氢气表示的反应速率;
(4)先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
(5)计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
(6)根据平衡常数和水的离子积常数综合求解,比较两种离子对应的弱电解质的电离度的大小确定溶液的酸碱性;
Ⅲ.电池正极发生还原反应,A是生成的氯化铵;
①依据反应转化率的大小分析,结合图象分析判断;
②根据氨气和二氧化碳的转化率之比求出x1.
Ⅱ.(1)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,以此判断.
(2)甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长;
(3)先计算出用氮气表示的反应速率,然后利用化学计量数关系计算出用氢气表示的反应速率;
(4)先将丙中的数据按照化学计量数转化成反应物氮气、氢气的物质的量,然后利用等效平衡知识进行分析;
(5)计算出反应前氮气、氢气的物质的量浓度,然后利用化学平衡三段式计算出达到平衡时各组分的浓度,最后根据化学平衡常数表达式计算出该温度下的平衡常数;
(6)根据平衡常数和水的离子积常数综合求解,比较两种离子对应的弱电解质的电离度的大小确定溶液的酸碱性;
Ⅲ.电池正极发生还原反应,A是生成的氯化铵;
①依据反应转化率的大小分析,结合图象分析判断;
②根据氨气和二氧化碳的转化率之比求出x1.
解答:
解:Ⅰ.图1、图2、图3写出热化学方程式分别为:
①CO(g)+
O2(g)═CO2(g)△H=-akJ?mol-1
②H2(g)+
O2(g)═H2O(g)△H=-bkJ?mol-1
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-ckJ?mol-1
由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=(a+3b-c)kJ?mol-1,
故答案为:(a+3b-c)kJ?mol-1;
Ⅱ.(1)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v(N2)正=v(H2)逆时,才说明达到平衡状态,故b错误;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.恒容时体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:c;
(2)若为恒压容器,甲乙容器中达到平衡所用时间相同,为5min,但是容器恒容,甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长,即t>5min,故答案为:>;
(3)容器乙中,反应前氮气的浓度为:
=4mol/L,氮气的平均反应速率为:v(N2)=
=0.2mol?L-1?min-1,故答案为:0.2 mol?L-1?min-1;
(4)恒温、恒容条件下:
a.假设乙容器的容积为2L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c1,然后将容器的容积缩小到2L,若平衡不移动,2c1=3mol/L,由于压强增大,平衡向着正向移动,所以2c1>3mol/L,故a错误;
b.乙中加入了4mol氮气、6mol氢气,而甲中为3mol H2、2mol N2,故乙对甲来说相当于加压,平衡右移,氮气的体积分数减小,所以ω2<ω1,故b错误;
c.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=
,可知:2ρ1=ρ2,故c正确;
故选c;
(5)乙容器中,反应前氢气浓度为:c(H2)=
=4mol/L,氮气的浓度为:
=4mol/L,达到平衡时氮气的浓度变化为:(4-3)=1mol/L,
由三段式可知:3H2 (g)+N2(g)?2NH3(g)
反应前(mol/L):6 4 0
浓度变化(mol/L):3 1 2
反应后:(mol/L):3 3 2
在该温度下乙容器中反应的平衡常数K=
=
,
故答案为:
;Ⅰ.△H=+(a+3b-c) (2分)
(6)NH4+(aq)+H2O(l)?NH3?H2O(aq)+H+(aq)平衡常数的表达式为:K=
=
=
=5.55×10-10mol?L-1,所以Kb=1.80×10-5mol?L-1,因为Ka1=5.9×10-2>Kb,所以草酸氢铵的水溶液中,呈酸性,所以离子浓度的大小顺序为:C(NH4+)>C(HC2O4-)>C(H+)>C(C2O42-)>C(OH-),故答案为:C(NH4+)>C(HC2O4-)>C(H+)>C(C2O42-)>C(OH-);
Ⅲ.(1)电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵,故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
由题意可知:2NH3(g)+CO2(g)?CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:
=
,
=40%,
=60%,则x1=3,
故答案为:3.
①CO(g)+
| 1 |
| 2 |
②H2(g)+
| 1 |
| 2 |
③CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-ckJ?mol-1
由③-(①+②×3)得:CH4(g)+H2O(g)═CO(g)+3H2(g)△H=(a+3b-c)kJ?mol-1,
故答案为:(a+3b-c)kJ?mol-1;
Ⅱ.(1)a.容器内N2、H2、NH3的浓度之比为1:3:2,不能说明达到判断状态,取决于起始配料比和转化程度,故a错误;
b.当3v(N2)正=v(H2)逆时,才说明达到平衡状态,故b错误;
c.容器内压强保持不变,可说明达到平衡状态,故c正确;
d.恒容时体积不变,质量不变,则混合气体的密度保持不变,不能达到平衡状态,故d错误.
故答案为:c;
(2)若为恒压容器,甲乙容器中达到平衡所用时间相同,为5min,但是容器恒容,甲容器比乙容器中反应物的浓度小,反应速率比乙中小,故达到平衡所需要的时间更长,即t>5min,故答案为:>;
(3)容器乙中,反应前氮气的浓度为:
| 4mol |
| 1L |
| (4-3)mol/L |
| 5min |
(4)恒温、恒容条件下:
a.假设乙容器的容积为2L,则达到平衡时甲乙为等效平衡,各组分的含量、浓度相等,此时氮气的浓度为c1,然后将容器的容积缩小到2L,若平衡不移动,2c1=3mol/L,由于压强增大,平衡向着正向移动,所以2c1>3mol/L,故a错误;
b.乙中加入了4mol氮气、6mol氢气,而甲中为3mol H2、2mol N2,故乙对甲来说相当于加压,平衡右移,氮气的体积分数减小,所以ω2<ω1,故b错误;
c.反应前后都是气体,容器的容积都是2L,乙中混合气体的质量为甲的2倍,根据ρ=
| m |
| V |
故选c;
(5)乙容器中,反应前氢气浓度为:c(H2)=
| 6mol |
| 1L |
| 4mol |
| 1L |
由三段式可知:3H2 (g)+N2(g)?2NH3(g)
反应前(mol/L):6 4 0
浓度变化(mol/L):3 1 2
反应后:(mol/L):3 3 2
在该温度下乙容器中反应的平衡常数K=
| 22 |
| 33×3 |
| 4 |
| 81 |
故答案为:
| 4 |
| 81 |
(6)NH4+(aq)+H2O(l)?NH3?H2O(aq)+H+(aq)平衡常数的表达式为:K=
| c(NH3?H2O)×c(H+) | ||
c(N
|
| c(NH3?H2O)×C(H+)×c(OH-) | ||
c(N
|
| Kw |
| Kb |
Ⅲ.(1)电池正极发生还原反应,氮气得电子发生还原反应,N2+8H++6e-=2NH4+,A是铵根离子与氯离子结合形成氯化铵,故答案为:N2+8H++6e-=2NH4+;氯化铵;
(2)氨碳比相同时曲线Ⅰ二氧化碳的转化率大,所以生产中选用水碳比的数值为Ⅲ,故答案为:Ⅲ;
由题意可知:2NH3(g)+CO2(g)?CO(NH2)2+H2O(g)
起始量 x1 1
变化量 2a a
即:
| 2a |
| x1 |
| a |
| 1 |
| x1 |
| 2a |
| 1 |
| a |
故答案为:3.
点评:本题考查较为综合,涉及化学反应与能量、化学平衡的影响因素、化学平衡、速率的计算等,侧重于学生的分析能力和计算能力的考查,为高考常见题型和高频考点,注意利用三段式法计算,较为直观,难度不大.

练习册系列答案
相关题目
已知图①~④的相关信息,下列相应叙述正确的是( )
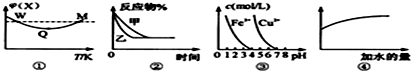

| A、图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,W点X的正反应速率等于M点X的正反应速率 |
| B、图②表示压强对可逆反应A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C、据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D、常温下,稀释0.1mol/L Na2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
化学与科学、技术、社会、环境密切相关,下列有关说法正确的是( )
| A、PM2.5是指大气中直径小于或等于2.5微米的颗粒物,对人体健康或环境有很大影响 |
| B、同位素示踪法、分光光度法、核磁共振技术都是研究化学反应历程的重要手段 |
| C、垃圾焚烧不仅可以用于发电,还不会带来任何新污染 |
| D、地沟油的主要成分是高级脂肪酸甘油酯,故允许加工为食用油,也可用于制肥皂 |
列关于①苯、②乙醇、③乙酸、④葡萄糖等有机物的叙述中,不正确的是( )
| A、可以用新制氢氧化铜鉴别③与④ |
| B、只有③能与金属钠反应 |
| C、①、②、③均能发生取代反应 |
| D、一定条件下,④可以转化为② |
雌二醇和炔雌醇是两种雌激素用药,它们的结构简式如下,关于它们的说法不正确的是( )
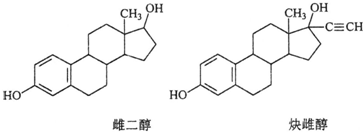

| A、核磁共振氢谱峰数相同 |
| B、均能发生加成反应、取代反应、消去反应 |
| C、两种分子中所有碳原子不可能在同一个平面内 |
| D、可用FeCl3溶液鉴别 |
下列解释实验事实的化学方程式正确的是( )
A、5mol Fe和4mol Cl2反应:5Cl2+4Fe
| ||||
| B、2mol KMnO4和3mol H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+═Mn2++4O2↑+6H2O | ||||
| C、在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-═CO32-+6H2O | ||||
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-═2Al(OH)3↓+CO32- |