题目内容
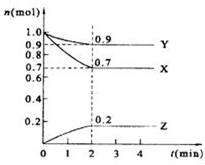 某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示.(1)由图中所给数据进行分析,该反应的化学方程式为
(2)反应从开始至2分钟末,用Z的浓度变化表示的平均反应速率为
(3)达到平衡是X的浓度是
(4)当反应进行到第
A.增大反应物的浓度 B.升高温度 C.使用正催化剂.
考点:物质的量或浓度随时间的变化曲线
专题:化学平衡专题
分析:(1)根据物质的量变化曲线,可知X、Y物质的量减小,为反应物;反应物没有完全反应,所以该反应为可逆反应;Z物质的量增加,为生成物,再根据其物质的量变化量之比等于其计量数之比,可写出化学方程式;
(2)根据2min内Z物质的量变化量和容器体积,可知道浓度变化量,通过计算可知用气体Z表示的反应速率;
(3)观察图象中曲线判断化学平衡状态,计算该状态下X浓度;
(4)根据影响化学反应速率的影响条件获得答案.
(2)根据2min内Z物质的量变化量和容器体积,可知道浓度变化量,通过计算可知用气体Z表示的反应速率;
(3)观察图象中曲线判断化学平衡状态,计算该状态下X浓度;
(4)根据影响化学反应速率的影响条件获得答案.
解答:
解:(1)△n(X)=0.3mol;△n(Y)=0.1mol;△n(Z)=0.2mol,所以三者计量数之比为3:1:2,方程式为3X+Y?2Z,故答案为:3X+Y?2Z;
(2)2分钟末,Z的浓度变化为
=0.1mol/L,用Z表示化学反应速率为
=0.05mol/(l.min),故答案为:0.05mol/(l.min);
(3)观察图象2min末达到化学平衡状态,此时X物质的量为0.7mol,浓度为
=0.35mol/L,故答案为:0.35mol/l;
(4)2min末达到化学平衡状态;增大反应物的浓度、升高温度、使用正催化剂都可以加快化学反应速率,故答案为:2、ABC.
(2)2分钟末,Z的浓度变化为
| 0.2mol |
| 2L |
| 0.1mol/L |
| 2min |
(3)观察图象2min末达到化学平衡状态,此时X物质的量为0.7mol,浓度为
| 0.7mol |
| 2L |
(4)2min末达到化学平衡状态;增大反应物的浓度、升高温度、使用正催化剂都可以加快化学反应速率,故答案为:2、ABC.
点评:该题通过图象中物质的物质的量的变化,来考查化学平衡的移动、化学反应速率计算,综合考查学生对知识的综合应用能力.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
下列事实中,能说明氯的非金属性比硫强的是( )
①HClO的氧化性比H2SO4的氧化性强
②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强
④HCl比H2S稳定
⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价
⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
①HClO的氧化性比H2SO4的氧化性强
②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强
④HCl比H2S稳定
⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价
⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A、①②③④⑤⑥⑦⑧ |
| B、①④⑤⑥⑦ |
| C、④⑤⑥⑦⑧ |
| D、③④⑤⑦⑧ |
常温下,铁与下列酸溶液作用产生H2的是( )
| A、硅酸 | B、浓硫酸 |
| C、稀盐酸 | D、稀硝酸 |
关于“植物油”的叙述错误的是( )
| A、属于酯类 |
| B、不含碳碳双键 |
| C、比水轻 |
| D、在碱和加热条件下能完全水解 |
下列说法正确的是( )


| A、装置甲不能防止铁钉生锈 |
| B、装置乙可除去乙烯中混有的乙炔 |
| C、装置丙可用于实验室制取乙酸乙酯 |
| D、装置丁可用于收集H2、CO2、Cl2、HCl、NO2等气体 |
短周期元素X、Y、Z、W的原子序数依次增大,X的原子在元素周期表中原子半径最小,Y的次外层电子数是最外层的
,ZX2是一种储氢材料,W与Y属于同一主族.下列叙述正确的是( )
| 1 |
| 3 |
| A、原子半径:rW>rZ>rY |
| B、Y形成的离子与W形成的离子的电子数不可能相同 |
| C、化合物X2Y、ZY、WY3中化学键的类型相同 |
| D、由X、Y、Z、W组成的化合物的水溶液可能显酸性 |