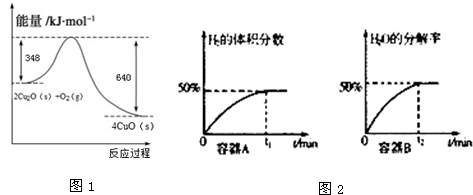
题目内容
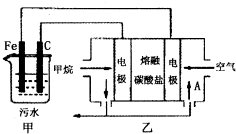 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了增加污水的导电能力,应向污水中如入适量的H2SO4溶液 |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48L |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:甲装置为电解池,乙装置为原电池装置,原电池工作时,通入甲烷的一级为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入氧气的一级为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-,电解池中Fe为阳极,发生Fe-2e-=Fe2+,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,以此解答该题.
解答:
解:A.电池是以熔融碳酸盐为电解质,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,正极反应为O2+2CO2+4e-=2CO32-,可以循环利用的物质只有二氧化碳,故A正确;
B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B错误;
C.保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入的使导电能力增强的电解质必须是可溶于水的、显中性的盐,加入硫酸不能生成Fe(OH)3沉淀,故C错误;
D.阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当乙装置中有1.6 gCH4参加反应,即0.1mol甲烷参加反应时,有0.8mol电子转移,则C电极理论上生成气体在标准状况下为8.96L,故D错误.
故选A.
B.电解池中Fe为阳极,发生Fe-2e-=Fe2+,故B错误;
C.保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀时,加入的使导电能力增强的电解质必须是可溶于水的、显中性的盐,加入硫酸不能生成Fe(OH)3沉淀,故C错误;
D.阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的氢气产生,所以转移电子的物质的量为4mol,根据电池的负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,当乙装置中有1.6 gCH4参加反应,即0.1mol甲烷参加反应时,有0.8mol电子转移,则C电极理论上生成气体在标准状况下为8.96L,故D错误.
故选A.
点评:本题考查了燃料电池的工作原理和原电池和电解池串联的综合知识,难度较大.注意把握电解池和原电池的工作原理,把握电极方程式的书写,为解答该题的关键.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
下列离子方程式书写正确的是( )
| A、少量CO2通入Ba(OH)2溶液中:CO2+2OH-═CO32-+H2O |
| B、NH4Al(SO4)2溶液中滴入Ba(OH)2溶液至SO42-恰好沉淀完全:NH4++Al3++2SO42-+2Ba2++4OH-═NH3?H2O+Al(OH)3↓+2BaSO4↓ |
| C、FeCl3溶液腐蚀铜线路板:Fe3++Cu═Fe2++Cu2+ |
| D、向NaHCO3溶液中滴入少量Ca(OH)2溶液:HCO3-+OH-═CO32-+H2O |
下列关于化学键的说法中不正确的是( )
| A、化学键是一种作用力 |
| B、化学键可以使离子相结合,也可以使原子相结合 |
| C、分子间作用力又称范德华力,它属于化学键 |
| D、化学反应过程中,反应物分子内的化学键断裂,生成物分子中的化学键形成 |
下列说法正确的是( )
| A、科恩和渡普尔因理论化学方面的贡献获得化学界最高成就诺贝尔化学奖,标志着化学已成为以理论研究为主的学科 |
| B、PM2.5表示每立方米空气中直径小于或等于2.5微米的颗粒物的含量,PM2.5值越高,大气污染越严重.因此由PM2.5引起的雾霾一定属于气溶胶 |
| C、对“地沟油”加工处理可以达到变废为宝的目的,比如对“地沟油”进行分馏可以制得汽油、煤油 |
| D、采取“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”等方法,以提高空气质量;推广可利用太阳能、风能等新能源,发展低碳经济,同时能大大减少对环境的污染 |
 央视“315特别行动”曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某种“瘦肉精”含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,正确的是( )
央视“315特别行动”曝光了河南一些地方“瘦肉精”事件.“瘦肉精”对人体健康会产生危害.已知某种“瘦肉精”含有克伦特罗(Clenbuterol),其结构如图.下列有关克伦特罗的叙述,正确的是( )| A、该物质的分子式为C12H17ON2Cl |
| B、该物质不溶于盐酸 |
| C、该物质能与FeCl3溶液发生显色反应 |
| D、该物质分子间都可以形成氢键 |
已知图①~④的相关信息,下列相应叙述正确的是( )
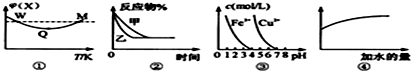

| A、图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,W点X的正反应速率等于M点X的正反应速率 |
| B、图②表示压强对可逆反应A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C、据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D、常温下,稀释0.1mol/L Na2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
下列事实中,能说明氯的非金属性比硫强的是( )
①HClO的氧化性比H2SO4的氧化性强
②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强
④HCl比H2S稳定
⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价
⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
①HClO的氧化性比H2SO4的氧化性强
②常温下氯气是气态而硫是固态
③盐酸酸性比氢硫酸强
④HCl比H2S稳定
⑤H2S能被Cl2氧化成硫
⑥SCl2分子中氯显-1价
⑦氯气与氢气化合比硫与氢气化合要容易进行
⑧Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS.
| A、①②③④⑤⑥⑦⑧ |
| B、①④⑤⑥⑦ |
| C、④⑤⑥⑦⑧ |
| D、③④⑤⑦⑧ |
某同学按如图所示的装置进行实验,A、B为常见金属,它们的硫酸盐可溶于水.当K闭合时,X电极附近溶液先变红.下列分析不正确的是( )


| A、A的金属活动性强于B |
| B、Y的电极反应:2Cl--2e-═Cl2↑ |
| C、阴离子交换膜处的SO42-从左向右移动 |
| D、当电路中有0.1mol电子通过时B电极有0.05mol金属析出 |