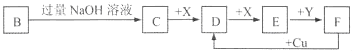题目内容
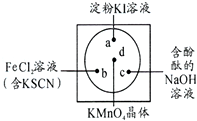 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.根据上述描述涉及到的元素,回答下列问题.
(1)KMnO4中Mn元素的化合价为:
(2)第三周期原子半径最小的原子共有
(3)结合已学知识分析a、c处的可能出现的现象:a:
(4)b处可能发生反应的离子方程式:
考点:氯气的化学性质,元素周期表的结构及其应用
专题:卤族元素
分析:(1)根据化合价规则结合元素周期表的结构来确定元素的化合价以及元素的位置;
(2)第三周期原子半径最小的原子是Cl,卤素原子和长周期主族元素形成化合物属于离子化合物;
(3)氯气能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色,氯气还能和强碱氢氧化钠之间反应生成氯化钠、次氯酸钠和水;
(4)氯气能将亚铁离子氧化为三价铁,遇到硫氰化钾显示红色.
(2)第三周期原子半径最小的原子是Cl,卤素原子和长周期主族元素形成化合物属于离子化合物;
(3)氯气能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色,氯气还能和强碱氢氧化钠之间反应生成氯化钠、次氯酸钠和水;
(4)氯气能将亚铁离子氧化为三价铁,遇到硫氰化钾显示红色.
解答:
解:(1)KMnO4中K是+1价,O是-2价,所以Mn元素的化合价为+7,在周期表中,位于第四周期Ⅷ族,故答案为:+7;第四周期Ⅷ族;
(2)第三周期原子半径最小的原子 Cl,电子排布式为1s22s22p63s23p5,共有5种不同能量的电子,长周期主族元素形成化合物是离子化合物,以碘化钾的电子式为例,的电子式为: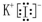 ,故答案为:5;
,故答案为:5;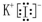 ;
;
(3)高锰酸钾遇到浓盐酸会立即产生氯气,氯气能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色,氯气还能和强碱氢氧化钠之间反应生成氯化钠、次氯酸钠和水,所以原来氢氧化钠的碱性消失,次氯酸钠水解显示弱碱性,会看到溶液红色消失或是变浅,故答案为:溶液变为蓝色;红色褪去(或红色变浅);
(4)氯气能将亚铁离子氧化为三价铁,2Fe2++Cl2=2Fe3++2Cl-,铁离子遇到硫氰化钾显示红色,发生络合反应即Fe3++3SCN-=Fe(SCN)3,故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
(2)第三周期原子半径最小的原子 Cl,电子排布式为1s22s22p63s23p5,共有5种不同能量的电子,长周期主族元素形成化合物是离子化合物,以碘化钾的电子式为例,的电子式为:
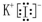 ,故答案为:5;
,故答案为:5;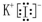 ;
;(3)高锰酸钾遇到浓盐酸会立即产生氯气,氯气能将碘离子氧化为碘单质,碘单质遇到淀粉显示蓝色,氯气还能和强碱氢氧化钠之间反应生成氯化钠、次氯酸钠和水,所以原来氢氧化钠的碱性消失,次氯酸钠水解显示弱碱性,会看到溶液红色消失或是变浅,故答案为:溶液变为蓝色;红色褪去(或红色变浅);
(4)氯气能将亚铁离子氧化为三价铁,2Fe2++Cl2=2Fe3++2Cl-,铁离子遇到硫氰化钾显示红色,发生络合反应即Fe3++3SCN-=Fe(SCN)3,故答案为:2Fe2++Cl2=2Fe3++2Cl-、Fe3++3SCN-=Fe(SCN)3.
点评:本题以氯气的性质为载体考查学生氧化还原反应的有关知识,注意反应的发生以及伴随的明显现象是关键,难度不大.

练习册系列答案
相关题目
在水中存在H2O?H++OH-平衡,加入下列哪种物质或进行哪项操作,不会使平衡发生移动( )
| A、加入NaOH固体 |
| B、加入NaCl固体 |
| C、加入CH3COOH固体 |
| D、升温 |
已知H2A为弱酸,下列说法错误的是( )
| A、0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 |
| C、常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 |
| D、常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9 |

 随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
随着世界工业经济的发展、人口的剧增,全球能源紧张面临着越来越严重的问题,煤经过化学加工可转化为气体或液体以及各种化工产品,从而提高了煤的利用率.
 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);