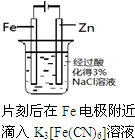
题目内容
已知H2A为弱酸,下列说法错误的是( )
| A、0.1mol/L的Na2A溶液中:c(A2-)+c(HA-)+c(H2A)=0.1mol/L |
| B、常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液的pH<5 |
| C、常温下,将pH=3的H2A溶液与pH=11的NaOH溶液等体积混合,反应混合液呈酸性 |
| D、常温下,若1mol/L的NaHA溶液的pH=9,则溶液中:c(Na+)-c(HA-)-c(A2-)=10-5-10-9 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A.任何电解质溶液中都存在物料守恒,根据物料守恒判断;
B.加水稀释促进弱电解质电离,常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液中氢离子浓度大于原来的
;
C.常温下,pH=3的H2A溶液中c(H2A)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,二者等体积混合,溶液呈酸性;
D.常温下,若1mol/L的NaHA溶液的pH=9,则HA-的水解程度大于电离程度,根据电荷守恒、物料守恒判断.
B.加水稀释促进弱电解质电离,常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液中氢离子浓度大于原来的
| 1 |
| 100 |
C.常温下,pH=3的H2A溶液中c(H2A)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,二者等体积混合,溶液呈酸性;
D.常温下,若1mol/L的NaHA溶液的pH=9,则HA-的水解程度大于电离程度,根据电荷守恒、物料守恒判断.
解答:
解:A.任何电解质溶液中都存在物料守恒,根据物料守恒得c(A2-)+c(HA-)+c(H2A)=0.1mol/L,故A正确;
B.加水稀释促进弱电解质电离,常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液中氢离子浓度大于原来的
,则稀释后溶液的pH<5,故B正确;
C.常温下,pH=3的H2A溶液中c(H2A)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,二者等体积混合,酸有剩余,溶液呈酸性,故C正确;
D.常温下,若1mol/L的NaHA溶液的pH=9,则HA-的水解程度大于电离程度,根据电荷守恒得c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),
则c(Na+)-c(HA-)-c(A2-)=c(OH-)-c(H+)+c(A2-)>c(OH-)-c(H+)=10-5-10-9,故D错误;
故选D.
B.加水稀释促进弱电解质电离,常温下,将pH=3的H2A溶液稀释到原来的100倍,则稀释后溶液中氢离子浓度大于原来的
| 1 |
| 100 |
C.常温下,pH=3的H2A溶液中c(H2A)>10-3 mol/L,pH=11的NaOH溶液中c(NaOH)=10-3 mol/L,二者等体积混合,酸有剩余,溶液呈酸性,故C正确;
D.常温下,若1mol/L的NaHA溶液的pH=9,则HA-的水解程度大于电离程度,根据电荷守恒得c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),
则c(Na+)-c(HA-)-c(A2-)=c(OH-)-c(H+)+c(A2-)>c(OH-)-c(H+)=10-5-10-9,故D错误;
故选D.
点评:本题考查了弱电解质的电离,知道弱电解质电离特点结合电荷守恒、物料守恒等知识点来分析解答,题目难度不大.

练习册系列答案
相关题目
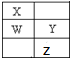 W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、常压下四种元素的单质中,X的非金属性最强 |
| B、四种元素都能与氧元素形成稳定的化合物 |
| C、Y、Z 离子最外层电子数相同 |
| D、Y元素具有两性元素 |
为把溴水中溴单质萃取出来,应加入( )
| A、苯 | B、苯酚溶液 | C、乙醇 | D、乙醛 |
下列说法中不正确的是( )
| A、乙烯与苯都能使溴水褪色,但褪色原理不同 |
| B、1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗氯气5mol |
| C、溴水遇到乙醛溶液出现褪色现象,是因为它们发生了氧化反应 |
D、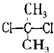 与 与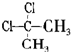 互为同分异构体 互为同分异构体 |
下列关于2mol?L-1 NaOH 溶液的说法中,不正确的是( )
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
下列化工生产过程中发生的反应,不属于氧化还原反应的是( )
| A、用氨气制硝酸 |
| B、用石灰石制生石灰 |
| C、用氯气制漂白粉 |
| D、从卤水中提取溴单质 |
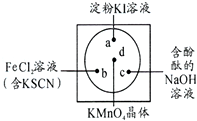 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.