题目内容
 已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);
已知B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质:Y在常温下为液态,E的相同对分子质量比D大16,它们存在如下转化关系(反应条件及部分产物已略去);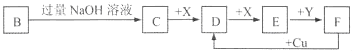
(1)将C气体通入稀盐酸中:若溶液呈中性,则除H+和OH-外,其它离子浓度的关系式为
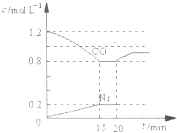
D气体和CO都是汽车尾气的主要成分,降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2D(g)+2CO(g)?N2(g)+2CO2(g)△H<0.若在一定温度下,将1.4mol D、1.2mol CO充入1L固定容积的密闭容器中,反应过程中各物质的浓度变化如图所示.
(2)该反应的化学平衡常数K=
(3)在图上画前20min CO2的浓度变化曲线
(4)若保持温度不变,20min时再向容器中充入CO、N2各0.8mol,平衡将
向右”或“不”)
(5)20min时,若改变反应条件,导致CO浓度发生如图所示的变化,则改变的条件可能是
A.缩小容器体积 B.增加CO2的量 C.升高温度 D.加入催化剂.
考点:化学平衡常数的含义,化学平衡的影响因素,无机物的推断
专题:推断题,化学平衡专题
分析:B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质,则B是NH4Cl;Y在常温下为液态,则Y是H2O;氯化铵和氢氧化钠反应生成氯化钠和氨气,C能和X反应生成D,D和X反应生成E,E的相对分子质量比D大16,则E比D多一个O原子,所以D和氧气反应生成E,X是氧气,C能和氧气反应,则C是氨气,D是一氧化氮,E是二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,则F是硝酸;
(1)C为氨气,通入入稀盐酸中若溶液呈中性,一水合氨略过量,依据电荷守恒分析判断;若溶液呈碱性,说明一水合氨过量;
(2)依据平衡常数概念和化学方程式计算,平衡移动原理判断反应进行方向;
(3)依据一氧化碳浓度减小0.4mol,结合化学方程式定量关系计算生成二氧化碳浓度为0.4mol/L,从0变化为0.4mol/L画出图象;
(4)依据加入一氧化碳和氮气的量计算此时浓度商和平衡常数进行比较判断平衡移动方向;
(5)图象分析一氧化碳浓度增大,说明平衡逆向进行,依据平衡移动原理分析判断选项;
(1)C为氨气,通入入稀盐酸中若溶液呈中性,一水合氨略过量,依据电荷守恒分析判断;若溶液呈碱性,说明一水合氨过量;
(2)依据平衡常数概念和化学方程式计算,平衡移动原理判断反应进行方向;
(3)依据一氧化碳浓度减小0.4mol,结合化学方程式定量关系计算生成二氧化碳浓度为0.4mol/L,从0变化为0.4mol/L画出图象;
(4)依据加入一氧化碳和氮气的量计算此时浓度商和平衡常数进行比较判断平衡移动方向;
(5)图象分析一氧化碳浓度增大,说明平衡逆向进行,依据平衡移动原理分析判断选项;
解答:
解:B是一种由三种短周期(各位于不同周期)元素组成的正盐,该盐在常用锌锰干电池中做电解质,则B是NH4Cl;Y在常温下为液态,则Y是H2O;氯化铵和氢氧化钠反应生成氯化钠和氨气,C能和X反应生成D,D和X反应生成E,E的相对分子质量比D大16,则E比D多一个O原子,所以D和氧气反应生成E,X是氧气,C能和氧气反应,则C是氨气,D是一氧化氮,E是二氧化氮,二氧化氮和水反应生成硝酸和一氧化氮,则F是硝酸;
(1)将C气体氨气通入稀盐酸中:若溶液呈中性,依据电荷守恒可知,c(NH4+)+c(H+)=c(Cl-)+c(OH-),c(H+)=c(OH-),则除H+和OH-外,其它离子浓度的关系式为c(NH4+)=c(Cl-),若溶液呈碱性,则存在的溶质NH3?H2O,NH4Cl,其离子浓度大小可能是c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+);
故答案为:c(NH4+)=c(Cl-),NH3?H2O,NH4Cl,c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+);
(2)反应达到平衡状态时,c(CO)=0.8mol/L,C(N2)=0.2mol/L,C(CO2)=2C(N2)=0.4mol/L,C(NO)=1.4mol/L-(1.2-0.8)mol/L=1mol/L,k=
L?mol-1=0.05 L?mol-1,反应是放热反应,升温平衡逆向进行,平衡常数减小;
故答案为:0.05 L?mol-1;减小;
(3)依据一氧化碳浓度减小0.4mol,结合化学方程式定量关系计算生成二氧化碳浓度为0.4mol/L,到15min达到平衡状态,15-20min浓度不再变化,从0变化为0.4mol/L画出图象为 ;
;
故答案为: ;
;
(4)加入氮气和一氧化碳的瞬间,C(N2)=(0.2+0.8)mol/L=1mol/L,c(CO)=1.6mol/L,浓度积常数=
=
>
,则平衡向逆反应方向移动;
故答案为:向左;
(5)平衡时一氧化碳的浓度增大,平衡向逆反应方向移动,
A.缩小容器体积平衡向正反应方向移动,故A错误;
B.增加CO2 的量平衡向逆反应方向移动,故B正确;
C.升高温度平衡向逆反应方向移动,故C正确;
D.加入催化剂不改变平衡移动,故D错误;
故选BC.
(1)将C气体氨气通入稀盐酸中:若溶液呈中性,依据电荷守恒可知,c(NH4+)+c(H+)=c(Cl-)+c(OH-),c(H+)=c(OH-),则除H+和OH-外,其它离子浓度的关系式为c(NH4+)=c(Cl-),若溶液呈碱性,则存在的溶质NH3?H2O,NH4Cl,其离子浓度大小可能是c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+);
故答案为:c(NH4+)=c(Cl-),NH3?H2O,NH4Cl,c(NH4+)>c(Cl-)>c(OH-)>c(H+)或c(NH4+)>c(OH-)>c(Cl-)>c(H+);
(2)反应达到平衡状态时,c(CO)=0.8mol/L,C(N2)=0.2mol/L,C(CO2)=2C(N2)=0.4mol/L,C(NO)=1.4mol/L-(1.2-0.8)mol/L=1mol/L,k=
| 0.42×0.2 |
| 12×0.82 |
故答案为:0.05 L?mol-1;减小;
(3)依据一氧化碳浓度减小0.4mol,结合化学方程式定量关系计算生成二氧化碳浓度为0.4mol/L,到15min达到平衡状态,15-20min浓度不再变化,从0变化为0.4mol/L画出图象为
 ;
;故答案为:
 ;
;(4)加入氮气和一氧化碳的瞬间,C(N2)=(0.2+0.8)mol/L=1mol/L,c(CO)=1.6mol/L,浓度积常数=
| 1×0.42 |
| 1.62×12 |
| 1 |
| 16 |
| 1 |
| 20 |
故答案为:向左;
(5)平衡时一氧化碳的浓度增大,平衡向逆反应方向移动,
A.缩小容器体积平衡向正反应方向移动,故A错误;
B.增加CO2 的量平衡向逆反应方向移动,故B正确;
C.升高温度平衡向逆反应方向移动,故C正确;
D.加入催化剂不改变平衡移动,故D错误;
故选BC.
点评:本题以物质的推断为载体考查化学平衡、氧化还原反应、离子反应、离子浓度大小比较等知识点,化学平衡常数的有关计算是高考热点,会分析平衡移动的影响因素,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
香叶醛分子的结构简式如图所示.下列叙述正确的是( )
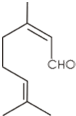

| A、1 mol香叶醛发生加成反应需要2 mol H2 |
| B、香叶醛不能与溴发生反应 |
| C、香叶醛能与钠发生反应生成H2 |
| D、香叶醛能发生银镜反应 |
下列各组物质均属于电解质的是( )
| A、SO2、Cl2、氨水 |
| B、AgCl、Ba(OH)2、HClO |
| C、NaOH、HCl、NaCl |
| D、酒精、Cu、蔗糖 |
下列离子方程式正确的是( )
| A、1mol Cl2通入含有2mol FeI2的溶液中:2Fe2++2I-+2Cl2═2Fe3++4Cl-+I2 |
| B、澄清石灰水与少量小苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O |
| C、AlCl3溶液中加入过量氨水:Al3++4OH-═AlO2-+2H2O |
| D、向银氨溶液中加入足量的盐酸:[Ag(NH3)2]++OH-+3H+═Ag++2NH4++H2O |
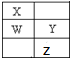 W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )
W、X、Y、Z为短周期元素,在周期表中的位置如图所示,有关元素W、X、Y、Z的叙述,不正确的是( )| A、常压下四种元素的单质中,X的非金属性最强 |
| B、四种元素都能与氧元素形成稳定的化合物 |
| C、Y、Z 离子最外层电子数相同 |
| D、Y元素具有两性元素 |
下列关于2mol?L-1 NaOH 溶液的说法中,不正确的是( )
| A、将80 g NaOH 溶于1 L水中,所得溶液中NaOH的物质的量浓度为2 mol?L-1 |
| B、1 L溶液中含2 mol NaOH |
| C、溶液中含2 mol钠离子和2 mol氢氧根离子 |
| D、溶液中钠离子的浓度是2 mol?L-1 |
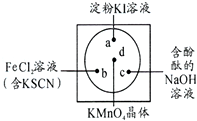 微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.
微型化学实验可以有效实现化学实验绿色化的要求.如图所示在一块衬白纸的玻璃片的不同位置分别滴加浓度为0.1mol/L的KI(含淀粉溶液)、NaOH的酚酞(C20H14O4)试液、FeCl2(含KSCN)溶液各一滴,在圆心处放置一粒芝麻大小的KMnO4的晶体,向KMnO4的晶体上滴加一滴浓盐酸,再立即用表面皿盖好.