题目内容
9.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程
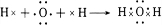 .
.(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,⑪为F.
(1)稀有气体原子最外层为稳定结构,化学性质最不活泼;
(2)同周期自左而右非金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强;
(3)电子层结构相同的离子,核电荷数越大离子半径越小;
(4)元素⑦的氢化物分子式为 H2O,属于共价化合物,用H原子、O原子电子式表示形成过程;
(5)⑧的最高价氧化物对应的水化物为高氯酸,①和⑨两元素形成化合物为溴化钠,该化合物灼烧时焰色为黄色,氯气与溴化钠反应生成氯化钠与溴单质.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为O、⑧为Cl、⑨为Br、⑩为Ar,⑪为F.
(1)稀有气体Ar原子最外层为稳定结构,化学性质最不活泼,故答案为:Ar;
(2)同周期自左而右非金属性减弱,同主族自上而下金属性增强,故金属性K>Na>Al,金属性越强,最高价氧化物对应水化物的碱性越强,则KOH的碱性最强,
故答案为:KOH;
(3)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:O2->F->Na+>Mg2+,
故答案为:O2->F->Na+>Mg2+;
(4)元素⑦的氢化物分子式为 H2O,属于共价化合物,用电子式表示该物质的形成过程: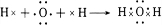 ,
,
故答案为:H2O;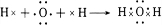 ;
;
(5)⑧的最高价氧化物对应的水化物为HClO4,①和⑨两元素形成化合物为溴化钠,该化合物灼烧时焰色为黄色,氯气与溴化钠反应生成氯化钠与溴单质,反应的离子方程式为:Cl2+2Br-=Br2+2Cl-,
故答案为:HClO4;NaBr;黄色;Cl2+2Br-=Br2+2Cl-.
点评 本题考查元素周期表与元素周期律,难度不大,注意整体把握元素周期律的结构,注意掌握用电子式表示物质或化学键的形成.

| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |

| A. | 官能团为碳碳双键、羧基 | B. | 与CH2=CHCOOCH3互为同分异构体 | ||
| C. | 能发生取代、加成和氧化反应 | D. | 分子中所有原子可能在同一平面 |
| A. | ②③④⑤ | B. | ②④⑥ | C. | ②③④⑤⑥⑦ | D. | ②⑤⑥ |
| A. | 石油的产量 | B. | 乙烯的产量 | C. | 汽油的产量 | D. | 硫酸的产量 |
| A. | C2H5OH | B. | CH4 | C. | C2H4 | D. | CH3COOCH2CH3 |
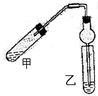 如图(铁架台、铁夹等省略)在试管甲中先加入碎瓷片,再加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上.在试管乙中加入5mL饱和碳酸钠溶液.按如图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验
如图(铁架台、铁夹等省略)在试管甲中先加入碎瓷片,再加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上.在试管乙中加入5mL饱和碳酸钠溶液.按如图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放