题目内容
19.用价层电子对互斥理论预测H2S和PCl3的立体结构,两个结论都正确的是( )| A. | 直线形;三角锥形 | B. | V形;三角锥形 | ||
| C. | 直线形;平面三角形 | D. | V形;平面三角形 |
分析 根据价层电子对互斥理论确定分子的空间构型,分子中中心原子价层电子对个数=σ个数+孤电子对个数,如果价层电子对个数是4且不含孤电子对,则为正四面体结构,如果价层电子对个数是4且含有一个孤电子对,则为三角锥形结构,如果价电子对个数是4且含有2个孤电子对,则为V形,据此分析解答.
解答 解:H2S中价层电子对个数=2+$\frac{1}{2}$×(6-2×1)=4且含有2个孤电子对,所以其立体结构为V形;
PCl3中价层电子对个数=3+$\frac{1}{2}$×(5-3×1)=4且含有1个孤电子对,所以其立体结构为三角锥形,
故选B.
点评 本题考查了分子空间构型的判断,为高考高频点,根据价层电子对互斥理论分析解答即可,注意孤电子对个数的计算方法,为易错点.

练习册系列答案
相关题目
9.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生反应的化学方程式有CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn可形成Cu-Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5.
②该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
(1)上述实验中发生反应的化学方程式有CuSO4+Zn═ZnSO4+Cu,Zn+H2SO4═ZnSO4+H2↑;
(2)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn可形成Cu-Zn原电池,加快了氢气产生的速率;
(3)实验室中现有Na2SO4、MgSO4、Ag2SO4、K2SO4等4种溶液,可与上述实验中CuSO4溶液起相似作用的是Ag2SO4;
(4)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等(答两种);
(5)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列的实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的CuSO4后,生成的单质Cu会沉积在Zn的表面,降低了Zn与H2SO4溶液的接触面积而使反应速率下降.
10.现有部分短周期元素的性质或原子结构如下表:
下列叙述中不正确的是( )
| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
7.下列有关化学反应速率的认识,正确的是( )
| A. | 增大压强(对于气体反应),活化分子总数必然增大,故反应速率增大 | |
| B. | 温度升高,分子动能增加,减小了活化能,故反应速率增大 | |
| C. | 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 | |
| D. | H+和OH-的反应活化能非常小,反应几乎在瞬间完成 |
4.用过量锌与稀硫酸反应制H2时,下列能延缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量蒸馏水 | D. | 改用98%的浓硫酸 |
8.设阿伏加德罗常数的值为NA,下列说法中不正确的是( )
| A. | 1mol甲基(-CH3)含有的电子数目为9NA | |
| B. | 28g乙烯和丙烯的混合气体中所含碳原子数为2NA | |
| C. | 1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA | |
| D. | 25℃时,1mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
9.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是Ar.
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程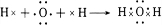 .
.
(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程
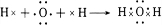 .
.(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
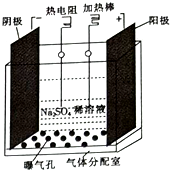 过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:
过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题: .根据要求回答下列问题:
.根据要求回答下列问题: .
. )都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.
)都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.