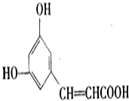
题目内容
1.通常用来衡量一个国家石油化工生产发展水平的标志是( )| A. | 石油的产量 | B. | 乙烯的产量 | C. | 汽油的产量 | D. | 硫酸的产量 |
分析 依据乙烯的用途可知,乙烯主要用于制造塑料、合成纤维、有机溶剂等,是石油化工发展的标志.
解答 解:乙烯工业的发展,带动了其他以石油为原料的石油化工的发展.因此一个国家乙烯工业的发展水平,已成为衡量这个国家石油化学工业水平的重要标志;
故选B.
点评 本题考查了乙烯的用途,注意工业发展的水平与石油产品的关系是解答本题的关键,题目较简单.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
12.对于反应2SO2(g)+O2(g)?2SO3(g) 最终能增大反应速率的措施是( )
| A. | 降低体系温度 | B. | 增大容器容积 | C. | 减小O2的浓度 | D. | 升高体系温度 |
9.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是Ar.
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程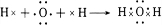 .
.
(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程
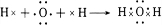 .
.(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
16.组成和结构可用 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )
 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 9种 | B. | 10种 | C. | 15种 | D. | 20种 |
6.下列说法不正确的是( )
| A. | 化学反应速率是通过实验测定的 | |
| B. | 升高温度,只能增大吸热反应速率,不能增大放热反应速率 | |
| C. | 对于任何反应,增大压强,相当于增大反应物的浓度,反应速率都加快 | |
| D. | 催化剂可降低反应所需活化能,提高活化分子百分数,从而提高反应速率 |
13.关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是( )
| A. | 两种酸溶液中c(CH3COO-)=c(Cl-) | |
| B. | 取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多 | |
| C. | 取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 | |
| D. | 取等体积的两种酸溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n |
11.如图所示的装置最适宜于收集的气体是( )


| A. | HCl | B. | NH3 | C. | NO | D. | NO2 |
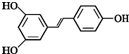 .根据要求回答下列问题:
.根据要求回答下列问题: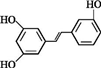 .
.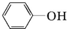 )都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.
)都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.