题目内容
17.某工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等).下列对该产品的描述不正确的是( )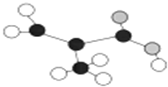
| A. | 官能团为碳碳双键、羧基 | B. | 与CH2=CHCOOCH3互为同分异构体 | ||
| C. | 能发生取代、加成和氧化反应 | D. | 分子中所有原子可能在同一平面 |
分析 由分子模型可知,有机物为CH2=C(CH3)COOH,含碳碳双键、-COOH,结合烯烃、羧酸的性质来解答.
解答 解:由分子模型可知,有机物为CH2=C(CH3)COOH,
A.含碳碳双键、羧基官能团,故A正确;
B.与CH2=CHCOOCH3的分子式相同,结构不同,互为同分异构体,故B正确;
C.含碳碳双键可发生加成、氧化反应,含-COOH可发生取代反应,故C正确;
D.含甲基为四面体构型,则所有原子不可能共面,故D错误;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意烯烃和羧酸的性质,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
7.下列有关化学反应速率的认识,正确的是( )
| A. | 增大压强(对于气体反应),活化分子总数必然增大,故反应速率增大 | |
| B. | 温度升高,分子动能增加,减小了活化能,故反应速率增大 | |
| C. | 选用适当的催化剂,分子运动加快,增加了碰撞频率,故反应速率增大 | |
| D. | H+和OH-的反应活化能非常小,反应几乎在瞬间完成 |
8.设阿伏加德罗常数的值为NA,下列说法中不正确的是( )
| A. | 1mol甲基(-CH3)含有的电子数目为9NA | |
| B. | 28g乙烯和丙烯的混合气体中所含碳原子数为2NA | |
| C. | 1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA | |
| D. | 25℃时,1mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
5.氮化铝(AlN)常用做砂轮及高温炉衬材料,熔化状态下不导电,可知它属于( )
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 无法判断 |
12.对于反应2SO2(g)+O2(g)?2SO3(g) 最终能增大反应速率的措施是( )
| A. | 降低体系温度 | B. | 增大容器容积 | C. | 减小O2的浓度 | D. | 升高体系温度 |
9.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是Ar.
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程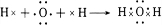 .
.
(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程
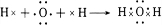 .
.(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
6.下列说法不正确的是( )
| A. | 化学反应速率是通过实验测定的 | |
| B. | 升高温度,只能增大吸热反应速率,不能增大放热反应速率 | |
| C. | 对于任何反应,增大压强,相当于增大反应物的浓度,反应速率都加快 | |
| D. | 催化剂可降低反应所需活化能,提高活化分子百分数,从而提高反应速率 |