题目内容
14.下列物质①乙烷②乙炔③甲苯④苯乙烯⑤聚乙烯⑥苯酚⑦乙醇,其中既能与溴水反应又能与酸性高锰酸钾溶液反应的是( )| A. | ②③④⑤ | B. | ②④⑥ | C. | ②③④⑤⑥⑦ | D. | ②⑤⑥ |
分析 碳碳不饱和键、苯环上酚羟基邻对位含有H原子的酚、醛基等都能和溴水反应,碳碳不饱和键、醛基、连接苯环的碳原子上含有H原子的苯的同系物都能被酸性高锰酸钾溶液氧化,据此分析解答.
解答 解:碳碳不饱和键、苯环上酚羟基邻对位含有H原子的酚、醛基等都能和溴水反应,碳碳不饱和键、醛基、连接苯环的碳原子上含有H原子的苯的同系物都能被酸性高锰酸钾溶液氧化,②④中含有碳碳双键,⑥中含有酚羟基且苯环上酚羟基邻对位有H原子,则能和酸性高锰酸钾溶液和溴反应的有②④⑥,乙烷和聚乙烯与二者都不反应,乙醇、甲苯能被酸性高锰酸钾溶液氧化,
故选B.
点评 本题考查有机物结构和性质,为高频考点,烯烃和苯酚都能与溴水和酸性高锰酸钾溶液反应,但二者反应原理不同,前者是加成反应或取代反应,而后者是氧化反应,注意:聚乙烯中不含碳碳双键.

练习册系列答案
相关题目
4.用过量锌与稀硫酸反应制H2时,下列能延缓反应速率但又不影响生成氢气总量的是( )
| A. | 加入少量NaNO3溶液 | B. | 加入少量CuSO4溶液 | ||
| C. | 加入少量蒸馏水 | D. | 改用98%的浓硫酸 |
5.氮化铝(AlN)常用做砂轮及高温炉衬材料,熔化状态下不导电,可知它属于( )
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 无法判断 |
9.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是Ar.
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程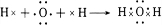 .
.
(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程
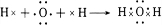 .
.(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
19.下列有关元素周期系的叙述正确的是( )
| A. | 元素周期系中ⅠA族元素又称为碱金属元素 | |
| B. | 元素周期系中每一周期元素的种类均相等 | |
| C. | 元素周期系的形成原因是核外电子排布的周期性变化 | |
| D. | 每一周期的元素最外层电子数均是1→8,周而复始 |
6.下列说法不正确的是( )
| A. | 化学反应速率是通过实验测定的 | |
| B. | 升高温度,只能增大吸热反应速率,不能增大放热反应速率 | |
| C. | 对于任何反应,增大压强,相当于增大反应物的浓度,反应速率都加快 | |
| D. | 催化剂可降低反应所需活化能,提高活化分子百分数,从而提高反应速率 |
3.元素X最高价态的氧化物的水化物为H3XO4,则X的氢化物的化学式是( )
| A. | XH3 | B. | H2X | C. | XH3 | D. | XH4 |
4.下列离子方程式正确的是( )
| A. | 铝溶于NaOH溶液:Al+2OH-═AlO2-+H2↑ | |
| B. | 稀硫酸中滴加氢氧化钡溶液:H++OH-═H2O | |
| C. | 碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| D. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu |