题目内容
20.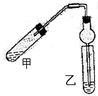 如图(铁架台、铁夹等省略)在试管甲中先加入碎瓷片,再加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上.在试管乙中加入5mL饱和碳酸钠溶液.按如图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验
如图(铁架台、铁夹等省略)在试管甲中先加入碎瓷片,再加入2mL 95%的乙醇,并在摇动下缓缓加入2mL浓硫酸,充分摇匀,冷却后再加入2g无水乙酸,用玻璃棒充分搅拌后将试管固定在铁架台上.在试管乙中加入5mL饱和碳酸钠溶液.按如图连接装置,用酒精灯对试管甲加热,当观察到试管乙中有明显现象时停止实验(1)实验中加入碎瓷片的作用是防止暴沸,试管乙中观察到的现象是饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味
(2)加入浓硫酸的目的是催化剂、吸水剂.
(3)该实验装置中使用球形管除起冷凝作用外,另一重要作用是防止发生倒吸.
(4)试管乙中饱和碳酸钠的作用是中和乙酸、溶解乙醇,减小酯在水中的溶解度
(5)写出上述反应的化学方程式CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
分析 (1)混合液态的沸点较低,加热时易发生爆沸,加热碎瓷片可以防止暴沸;根据乙酸乙酯不易溶于水、具有香味分析现象;
(2)酯化反应中,浓硫酸起到了催化剂和吸水剂的作用;
(3)乙醇和乙酸易溶于水,容易发生倒吸现象,用球形管可以起到防止倒吸的作用;
(4)乙酸乙酯在饱和碳酸钠溶液容易中的溶解度较小,且能够溶解乙醇、中和乙酸;
(5)乙醇与乙酸在浓硫酸作用下发生酯化反应生成乙酸乙酯和水,据此写出该反应的化学方程式.
解答 解:(1)实验中,试管中液态加热时易发生爆沸现象,需要加入碎瓷片防止暴沸;
乙酸乙酯在饱和碳酸钠溶液溶液中的溶解度较小,且具有香味,所以试管乙中观察到的现象为:饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味,
故答案为:防止暴沸;饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味;
(2)酯化反应为可逆反应,用浓硫酸吸水有利于乙酸乙酯的生成,另外浓硫酸还起到了催化剂的作用,
故答案为:催化剂、吸水剂;
(3)由于乙酸乙酯中混有的乙醇、乙酸易溶于水,易发生倒吸现象,所以该实验装置中使用球形管除起冷凝作用外,还可以起到防止倒吸的作用,
故答案为:防止发生倒吸;
(4)碳酸钠能够中和乙酸、溶解乙醇,且乙酸乙酯在饱和碳酸钠溶液容易中的溶解度减小,所以试管乙中饱和碳酸钠的作用是中和乙酸、溶解乙醇,减小酯在水中的溶解度,
故答案为:中和乙酸、溶解乙醇,减小酯在水中的溶解度;
(5)乙醇与乙酸发生酯化反应的方程式为:CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
点评 本题考查了制备方案的设计,题目难度不大,明确酯化反应原理为解答关键,注意掌握酯化反应中浓硫酸、饱和碳酸钠溶液溶液的作用,试题培养了学生的分析能力及化学实验能力.

| 元素符号 | 元素性质或原子结构 |
| T | M层上的电子数是原子核外电子层数的2倍 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
| A. | 14X可用与测定文物年代 | B. | Z的非金属性比T强 | ||
| C. | Y和T位于同一主族 | D. | X元素形成的化合物种类很多 |
| A. | 1mol甲基(-CH3)含有的电子数目为9NA | |
| B. | 28g乙烯和丙烯的混合气体中所含碳原子数为2NA | |
| C. | 1mol乙醛与足量新制Cu(OH)2悬浊液反应,转移电子数目为NA | |
| D. | 25℃时,1mol己烷完全燃烧后恢复至原状态,生成气态物质分子数为6NA |
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 无法判断 |
| A. | 降低体系温度 | B. | 增大容器容积 | C. | 减小O2的浓度 | D. | 升高体系温度 |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
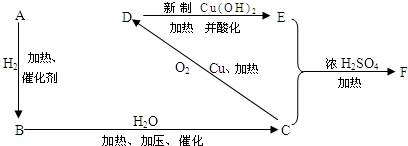
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程
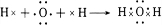 .
.(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
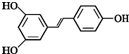 .根据要求回答下列问题:
.根据要求回答下列问题: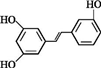 .
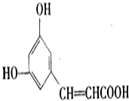
.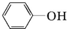 )都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.
)都含有与白藜芦醇相同的官能团,有关它们之间关系的说法正确的是C.