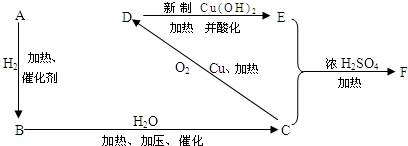
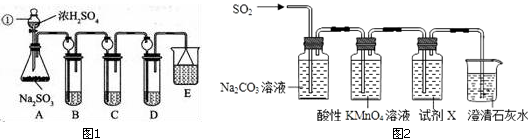
题目内容
4. 为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50mL密度为 1.1g/cm3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如图所示.请依图回答下列问题:
(1)放出一半气体所需要的时间为1 min;
(2)A、B、C、D各点反应速率快慢的顺序是D>C>B>A
(3)过氧化氢溶液的初始物质的量浓度为0.11 mol•L-1.
分析 反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,根据图象可知生成的氧气的体积,根据方程式计算过氧化氢浓度.
解答 解:(1)由图象可知,当放出一半气体所需要的时间为1min,故答案为:1 min;
(2)反应物浓度大小决定反应速率大小,随着反应的进行,双氧水的浓度逐渐减小,反应速率也随着减小,故答案为:D>C>B>A;
(3)由反应方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,该反应为不可逆反应,在5min后,收集到的气体体积不再增加,说明过氧化氢完全分解,
由图象可知,生成氧气的体积为60mL,
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
2mol 22.4L
n(H2O2) 0.06L
n(H2O2)=$\frac{2mol×0.06L}{22.4L}$=0.00536mol,所以c(H2O2)=$\frac{0.00536mol}{0.05L}$=0.11 mol•L-1,
故答案为:0.11 mol•L-1.
点评 本题考查过氧化氢分解的速率曲线,题目难度不大,主要考查浓度对反应速率的影响,注意对图象的分析.

练习册系列答案
相关题目
12.对于反应2SO2(g)+O2(g)?2SO3(g) 最终能增大反应速率的措施是( )
| A. | 降低体系温度 | B. | 增大容器容积 | C. | 减小O2的浓度 | D. | 升高体系温度 |
19.下列说法中不正确的是( )
| A. | 吸热反应不一定需要加热条件 | |
| B. | 放热反应只有化学键的形成,没有化学键的断开 | |
| C. | 化学反应除了生成新物质外,还伴随着能量的转化 | |
| D. | 稀酸和稀碱发生中和反应生成1 mol水所释放的热量称为中和热 |
9.下列为元素周期表中的一部分,用化学式或元素符号回答下列问题:
(1)11种元素中,化学性质最不活泼的是Ar.
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程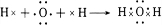 .
.
(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | VA | ⅥA | VⅡA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①②⑤中,最高价氧化物的水化物,碱性最强的物质化学式为KOH.
(3)①③⑦⑪中形成的简单离子半径由大到小的顺序是O2->F->Na+>Mg2+.
(4)元素⑦的氢化物分子式为H2O,用电子式表示该物质的形成过程
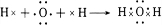 .
.(5)⑧的最高价氧化物对应的水化物化学式为HClO4.①和⑨两元素形成化合物的化学式为NaBr,该化合物灼烧时焰色为黄色,该化合物的溶液与元素⑧的单质反应的离子方程式为Cl2+2Br-=Br2+2Cl-.
16.组成和结构可用 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )
 表示的有机物中,能发生消去反应的共有( )
表示的有机物中,能发生消去反应的共有( )| A. | 9种 | B. | 10种 | C. | 15种 | D. | 20种 |
13.关于pH相同的醋酸和盐酸溶液,下列叙述不正确的是( )
| A. | 两种酸溶液中c(CH3COO-)=c(Cl-) | |
| B. | 取等体积的两种酸溶液分别中和NaOH溶液,醋酸消耗NaOH的物质的量比盐酸多 | |
| C. | 取等体积的两种酸溶液分别与完全一样的足量锌粒反应,开始时反应速率盐酸大于醋酸 | |
| D. | 取等体积的两种酸溶液分别进行稀释至原溶液的m倍和n倍,结果两溶液的pH仍然相同,则m>n |
 过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题:
过氧化氢是实验室常用的试剂,在医疗、军事及工业上用途也非常广泛.回答下列问题: