题目内容
19.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,不正确的是( )| A. | 它的原子半径比钠大,失电子能力不如钠 | |
| B. | 它的金属性比钠强,跟水反应会更剧烈 | |
| C. | 它的氢氧化物(FrOH)是一种强碱,遇酚酞溶液变红 | |
| D. | 它可与硫酸铜溶液反应,但是不易得到金属铜 |
分析 根据碱金属的性质递变进行分析判断,同主族从上到下原子半径依次增大,金属性增强,氢氧化物碱性依次增强,与水反应的剧烈程度依次增大,据此分析.
解答 解:A、同主族从上到下原子半径依次增大,金属性增强,则它的原子半径比钠大,失电子能力也比钠强,故A错误;
B、同主族从上到下金属性增强,失电子能力比钠强,则跟水反应会更剧烈,故B正确;
C、Fr处于第ⅠA族,最外层电子数为1,最高正化合价为+1,它的氢氧化物化学式为FrOH,同主族从上到下金属性增强,碱性比KOH强,遇酚酞溶液变红,故C正确;
D、同主族从上到下金属性增强,失电子能力比钠强,则跟水反应会更剧烈,所以与硫酸铜溶液反应,先与水反应,不易得到金属铜,故D正确;
故选A.
点评 本题考查同主族元素的性质的递变规律,注意同主族元素既具有性质的相似性,又具有递变性,难度不大.

练习册系列答案
相关题目
10.2004年2月2日,俄国杜布纳实验室宣布用核反应得到了两种新元素X和Y.X是用高能48Ca撞击${\;}_{95}^{243}$Am靶得到的.其质量数为288,质子数为115,则X元素原子核内中子数和核外电子数之差为( )
| A. | 58 | B. | 173 | C. | 3 | D. | 128 |
7.铁锅表面覆盖有下列物质时,锈蚀速率最快的是( )
| A. | 水 | B. | 食盐水 | C. | 食用油 | D. | 酒精 |
14.下列电子式书写正确的是( )
| A. | 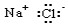 | B. |  | C. | 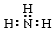 | D. |  |
4.臭氧可使湿润的淀粉碘化钾试纸变蓝,反应的化学方程式为:O3+2KI+H2O═2KOH+I2+O2,则下列说法正确的是( )
| A. | KI被氧化成KOH | |
| B. | KI是离子化合物,I2是共价化合物 | |
| C. | 1 mol O3 在反应中得到4 mol 电子 | |
| D. | KOH中既有离子键又有共价键 |
11.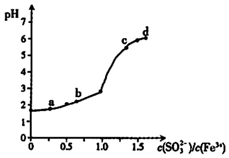 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
i.a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色:
ii.c点和d点溶液中产生红褐色沉淀,无气体逸出.取其上层清波滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色.
下列分析合理的是( )
 向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:
向FeCl3溶液中加入Na2SO3溶液,测定混合后溶液pH随混合前溶液中$\frac{c(S{O}_{3}^{2-})}{c(F{e}^{3+})}$变化的曲线如图所示.实验发现:i.a点溶液透明澄清,向其中滴加NaOH溶液后,立即产生灰白色沉淀,滴入KSCN溶液显红色:
ii.c点和d点溶液中产生红褐色沉淀,无气体逸出.取其上层清波滴加NaOH溶液后无明显现象,滴加KSCN溶液显红色.
下列分析合理的是( )
| A. | 向a点溶液中滴加BaCl2溶液,无明显现象 | |
| B. | b点较a点溶液pH升高的主要原因:2Fe3++SO32-+H2O═2Fe2++SO42-+2H+ | |
| C. | c点溶液中发生的主要反应:2Fe3++3SO32-+6H2O?2Fe( OH)3+3H2SO3 | |
| D. | 向d点上层清液中滴加KSCN溶液,溶液变红;再滴加NaOH溶液,红色加深 |
8.下列有关有机物结构和性质的描述正确的是( )
| A. | 甲苯、氯乙烯、苯乙炔分子内所有原子一定在同一平面上 | |
| B. | 苯、乙烯、聚乙烯都能发生加成反应,也能发生氧化反应 | |
| C. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 | |
| D. | 分子式为C5H10O2,能发生水解反应但不能发生银镜反应的有机物有5种 |
9.下列有关100mL 0.1mol•L-1 (NH4)2Fe(SO4)2溶液的叙述正确的是( )
| A. | 与K+、Na+、AlO2-、CO32-可以大量共存 | |
| B. | 可用铁氰化钾溶液检验该溶液是否变质 | |
| C. | 与100mL 0.1mol/L Ba(OH)2反应的离子方程式:Ba2++2OH-+SO42-+2NH4+═BaSO4↓+2NH3•H2O | |
| D. | 与足量酸性KMnO4溶液混合充分反应,共转移电子0.01mol |