题目内容
9.研究CO2的利用对促进低碳社会的构建具有重要意义.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
已知:
Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJ•mol-1
C(s,石墨)+CO2(g)═2CO(g)△H2=+172.5kJ•mol-1
则CO还原Fe2O3(s)的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1.
(2)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H
①取一定体积CO2和H2的混合气体(物质的量之比为1:3),加入恒容密闭容器中,发生上述反应反应过程中测得甲醇的体积分数φ(CH3OH)与反应温度T的关系如图1所示,则该反应的△H<0(填“>”、“<”或“=”,下同).
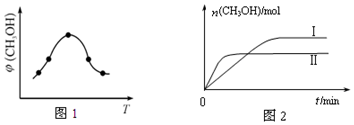
②在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图2所示,曲线I、Ⅱ对应的平衡常数关系为KⅠ>KⅡ.
(3)以CO2为原料还可以合成多种物质.
①工业上尿素[CO(NH2)2]由CO2和NH3在一定条件下合成.开始以氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
②将足量CO2通入饱和氨水中可得氮肥NH4HCO3,已知常温下一水合氨Kb=1.8×10-5,碳酸一级电离常数Ka=4.3×10-7,则NH4HCO3溶液呈碱性(填“酸性”、“中性”或“碱性”).
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式,①-②×3得到所需热化学方程式;
(2)①根据温度对平衡移动的影响判断反应热的符号;
②曲线Ⅱ到达平衡所用时间较短,则该条件下温度高,升高温度平衡逆移;
(3)①由CO2和NH3在一定条件下合成尿素[CO(NH2)2],根据质量守恒定律书写方程式,假设n(CO2)=1 mol,则n(NH3)=3mol.由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6 mol,根据方程式可知反应的NH3的物质的量,进而计算氨气的转化率;
②根据电离常数可知HCO3-水解强于NH4+水解,故显弱碱性.
解答 解:(1)①Fe2O3(s)+3CO(s,石墨)═2Fe(s)+3CO2(g)△H1=+489.0kJ•mol-1
②C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ•mol-1
依据盖斯定律①-②×3得到热化学方程式为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5 kJ•mol-1;
(2)①根据图象可知达到平衡后,温度越高,甲醇的体积分数φ(CH3OH)越小,说明升高温度平衡逆移,则正反应方向为放热反应,则△H<0,故答案为:<;
②根据图象可知曲线Ⅱ到达平衡所用时间较短,则该条件下温度高,升高温度平衡逆移,平衡常数减小,则曲线Ⅱ条件下平衡常数较小,即KⅠ>KⅡ;
故答案为:>;
(3)①根据质量守恒定律,由CO2和NH3在一定条件下合成尿素[CO(NH2)2]的反应方程式为:2NH3+CO2?CO(NH2)2+H2O,假设n(CO2)=1 mol,则n(NH3)=3mol,由于达平衡时CO2的转化率为60%,所以反应消耗的n(CO2)=0.6 mol,根据方程式可知反应的NH3的物质的量n(NH3)=1.2 mol,所以氨气的转化率为(1.2 mol÷3mol)×100%=40%,
故答案为:40%;
②一水合氨的电离常数大于HCO3-的电离常数,可知HCO3-水解程度强于NH4+水解程度,故NH4HCO3溶液呈弱碱性,
故答案为:碱性.
点评 本题题目难度中等,涉及热化学方程式书写、反应热的判断、电离平衡常数等知识,是对学生综合能力的考查,明确化学平衡及其影响为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及化学计算能力.

 名校课堂系列答案
名校课堂系列答案
下列说法正确的是( )
| A. | H2O2中只含有极性共价键,不含离子键 | |
| B. | 2NO2?N2O4的平衡常数K随温度升高而减小 | |
| C. | 向H2O2中加入Fe2(SO4)3后,B中颜色变浅 | |
| D. | H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小 |
| A. | 用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ | |
| B. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| C. | 硫化钠水溶液呈碱性的原因:S2-+2H2O?H2S↑+2OH- | |
| D. | 铝粉与NaOH溶液反应产生H2:2A1+2OH-+2H2O=2Al(OH)3↓+3H2↑ |
| A. | 石油分馏是物理变化,可获得汽油、煤油、柴油等产品 | |
| B. | C4H9Cl、C4H8Cl2的同分异构体种类分别有4种、9种(不含立体异构) | |
| C. | 淀粉和纤维素水解的最终产物不同 | |
| D. | 由乙酸生成乙酸乙酯属于取代反应 |
| A. | 硅是亲氧元素,在自然界中以化合态存在 | |
| B. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有元素中居第一位 | |
| C. | 硅的活泼性比碳强,只有在高温下才能跟氢气起化合反应 | |
| D. | 二氧化硅在电子工业中,是重要的半导体材料 |
| A. | 乙烯的结构式为CH2=CH2 | |
| B. | CH2Cl2属于正四面体的空间结构 | |
| C. | 乙炔是含碳量最高的烃 | |
| D. | 正戊烷分子中所有碳原子一定不在同一条直线上 |
| A. | 它的原子半径比钠大,失电子能力不如钠 | |
| B. | 它的金属性比钠强,跟水反应会更剧烈 | |
| C. | 它的氢氧化物(FrOH)是一种强碱,遇酚酞溶液变红 | |
| D. | 它可与硫酸铜溶液反应,但是不易得到金属铜 |

