题目内容
14.下列电子式书写正确的是( )| A. | 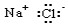 | B. |  | C. | 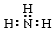 | D. |  |
分析 A.氯化钠为离子化合物,电子式中需要标出阴阳离子所带电荷,且阴离子需最外层达到8电子稳定结构;
B.水为共价化合物,氧原子最外层8个电子,分子中存在两个氧氢键,不存在离子键;
C.N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,与氢成对后满足8电子稳定结构;
D.氮气分子中两个N原子形成三对共用电子对.
解答 解:A.氯化钠属于离子化合物,电子式中钠离子形成离子符号形式,氯离子需要标出最外层电子,氯化钠正确的电子式为 ,故A错误;
,故A错误;
B.水中存在两个氧氢键,氧原子最外层达到8电子稳定结构,水的电子式为: ,故B错误;
,故B错误;
C.N原子的最外层有5个电子,其中3个未成对电子和1对成对电子,3个未成对电子分别和3个H原子形成3对共用电子对,故氨气的电子式为 ,故C错误;
,故C错误;
D.氮气分子中存在氮氮三键,氮原子最外层达到8电子稳定结构,氮气的电子式为 ,故D正确;
,故D正确;
故选D.
点评 本题考查了电子式的判断,该题是高考中的常见题型与重要的考点,主要是考查学生对常见化学用语的熟悉掌握程度,注意掌握电子式的概念及正确的表示方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 标准状况下,22.4LH2O2中所含H原子个数远大于2NA | |
| B. | 常温常压下,14.2g的Na2SO4和Na2S2O3的混合物含有Na原子个数为O.4NA | |
| C. | 标准状况下,1.5mol的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 3.6gD2O所含质子数为2NA |
9.某同学设计了如下实验测量mg铜银合金样品中铜的质量分数:
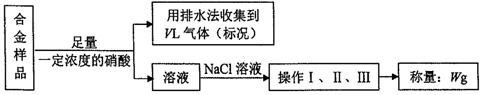
下列说法中不正确的是( )

下列说法中不正确的是( )
| A. | 铜、银都能与硝酸反应,收集到的VL气体全为NO | |
| B. | 操作I、II、III分别为过滤、洗涤、干燥 | |
| C. | 利用气体体积VL及样品质量mg可计算铜的质量分数 | |
| D. | 久置的银器变黑、铜绿的形成都发生了氧化还原反应 |
19.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,不正确的是( )
| A. | 它的原子半径比钠大,失电子能力不如钠 | |
| B. | 它的金属性比钠强,跟水反应会更剧烈 | |
| C. | 它的氢氧化物(FrOH)是一种强碱,遇酚酞溶液变红 | |
| D. | 它可与硫酸铜溶液反应,但是不易得到金属铜 |
3.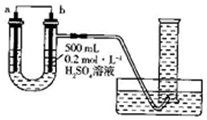 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )| A. | a电极的电极材料是铜 | |
| B. | 如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 | |
| C. | 锌与稀硫酸反应时放出的热量对实验测定不产生影响 | |
| D. | 若量筒中收集到a L H2,则电解质溶液中通过了$\frac{a}{11.2}$mol电子 |
4.阅读下列信息:
Ⅰ.表中①~⑥为短周期元素主要化合价及最简单氢化物沸点的数据:
A、B、C均为上表中的元素;
Ⅱ.A与B可形成化合物AB、AB2,二者可用于制备强酸甲;
Ⅲ.C与B可形成化合物CB2、CB3,二者可用于制备强酸乙.
请回答:
(1)该表中两种元素的氢化物所含电子数不同,这两种氢化物之间能发生反应,写出符合要求的化学方程式NH3+HCl=NH4Cl等(有多组符合,写出任意一个即可).
(2)元素②氢化物的沸点高于元素⑤氢化物的沸点,原因是水分子之间存在氢.
(3)甲、乙分别与氨反应生成丙、丁、戊三种盐.0.1mol/L的甲、乙、丙、丁、戊五种溶液,pH由小到大排列的顺序是(填写化学式)H2SO4、NH4HSO4、HNO3、(NH4)2SO4、NH4NO3.
(4)很稀的甲溶液与Zn反应,当反应的甲与Zn的物质的量之比为5:2时,还原产物可能为(填写化学式)NH4NO3、N2O.
Ⅰ.表中①~⑥为短周期元素主要化合价及最简单氢化物沸点的数据:
| 元素性质 | 元素编号 | |||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 氢化物沸点(℃) | -33.4 | 100 | 19.54 | -87.7 | -60.7 | -84.9 |
| 主要化合价 | +5 -3 | -2 | -1 | +5 -3 | +6 -2 | +7 -1 |
Ⅱ.A与B可形成化合物AB、AB2,二者可用于制备强酸甲;
Ⅲ.C与B可形成化合物CB2、CB3,二者可用于制备强酸乙.
请回答:
(1)该表中两种元素的氢化物所含电子数不同,这两种氢化物之间能发生反应,写出符合要求的化学方程式NH3+HCl=NH4Cl等(有多组符合,写出任意一个即可).
(2)元素②氢化物的沸点高于元素⑤氢化物的沸点,原因是水分子之间存在氢.
(3)甲、乙分别与氨反应生成丙、丁、戊三种盐.0.1mol/L的甲、乙、丙、丁、戊五种溶液,pH由小到大排列的顺序是(填写化学式)H2SO4、NH4HSO4、HNO3、(NH4)2SO4、NH4NO3.
(4)很稀的甲溶液与Zn反应,当反应的甲与Zn的物质的量之比为5:2时,还原产物可能为(填写化学式)NH4NO3、N2O.

 .
. .
. 某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.
某学习小组用如图所示装置A、B分别探究金属锌与稀硫酸的反应,实验过程中A烧杯内的溶液温度升高,B烧杯的电流计指针发生偏转,请回答以下问题.