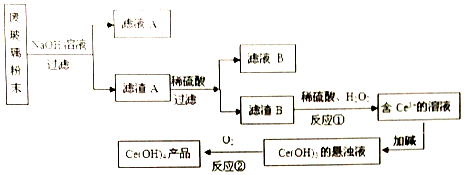
题目内容
8.下列有关有机物结构和性质的描述正确的是( )| A. | 甲苯、氯乙烯、苯乙炔分子内所有原子一定在同一平面上 | |
| B. | 苯、乙烯、聚乙烯都能发生加成反应,也能发生氧化反应 | |
| C. | 等质量的乙烯和乙醇完全燃烧,消耗氧气的物质的量相等 | |
| D. | 分子式为C5H10O2,能发生水解反应但不能发生银镜反应的有机物有5种 |
分析 A.甲苯含有甲基,具有甲烷的结构特点;
B.聚乙烯不能发生加成反应;
C.乙烯和乙醇与氧气均为1:3反应;
D.分子式为C5H10O2,能发生水解反应但不能发生银镜反应,说明不含醛基,不是甲酸酯.
解答 解:A.甲苯含有甲基,具有甲烷的结构特点,则所有原子一定不在同一平面上,故A错误;
B.聚乙烯为乙烯的加聚产物,不含碳碳双键,不能发生加成反应,虽然苯也不含碳碳双键,但苯为不饱和烃,可发生加成反应,故B错误;
C.乙烯和乙醇与氧气均为1:3反应,等物质的量的乙烯和乙醇完全燃烧消耗氧气的量相等,但等质量时消耗的氧气的量不同,故C错误;
D.分子式为C5H10O2,能发生水解反应但不能发生银镜反应,说明不含醛基,不是甲酸酯,对应的同分异构体可为乙酸与丙醇、丙酸与乙醇,丁酸与甲醇形成的酯,其中丙基有2种,则共有5种同分异构体,故D正确;故选D.
点评 本题综合考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,本题注意同分异构体的判断,为该题的易错点,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.下列关于有机物结构或性质说法正确的是( )
| A. | 乙烯的结构式为CH2=CH2 | |
| B. | CH2Cl2属于正四面体的空间结构 | |
| C. | 乙炔是含碳量最高的烃 | |
| D. | 正戊烷分子中所有碳原子一定不在同一条直线上 |
19.碱金属钫(Fr)具有放射性,它是碱金属元素中最重的元素,下列对其性质的预言中,不正确的是( )
| A. | 它的原子半径比钠大,失电子能力不如钠 | |
| B. | 它的金属性比钠强,跟水反应会更剧烈 | |
| C. | 它的氢氧化物(FrOH)是一种强碱,遇酚酞溶液变红 | |
| D. | 它可与硫酸铜溶液反应,但是不易得到金属铜 |
3.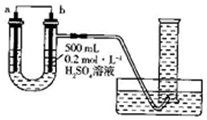 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
 利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )
利用如图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和铜片中无杂质,气体体积已转换为标准状况.下列说法正确的是( )| A. | a电极的电极材料是铜 | |
| B. | 如果将稀硫酸换为CuSO4溶液,则不能达到实验目的 | |
| C. | 锌与稀硫酸反应时放出的热量对实验测定不产生影响 | |
| D. | 若量筒中收集到a L H2,则电解质溶液中通过了$\frac{a}{11.2}$mol电子 |
13.设NA为阿伏加德罗常数的数值,下列叙述中正确的是( )
| A. | 2mol•L-1 NaCl溶液中含有Na+个数为NA | |
| B. | 标准状况下,22.4 L H2O含有的水分子数为NA | |
| C. | 71g氯气与足最铁粉充分反应,转移的电子数为3NA | |
| D. | 标准状况下,16g O2和O3的混合气体中原子总数为NA |
20.能用共价键键能大小解释的性质是( )
| A. | 稳定性:HCl>HI | B. | 密度:HI>HCl | C. | 沸点:HI>HCl | D. | 还原性:HI>HCl |
17.属于工业固氮的是( )
| A. | N2与O2反应生成NO | B. | 由NH3转变成 NH4HCO3 | ||
| C. | N2与H2在一定条件下反应生成NH3 | D. | 豆科植物的根瘤吸收氮 |
18.下列关于有机物的说法正确的是( )
| A. | 异戊烷和2-甲基丁烷互为同系物 | |
| B. | 丙烯分子中所有原子均在同一平面上 | |
| C. | 苯能发生氧化反应、还原反应和取代反应 | |
| D. | 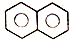 和C4H10的二氯代物数目相同 和C4H10的二氯代物数目相同 |