题目内容
17.“北大富硒康”中含有微量元素硒(Se),对人体有保健作用.已知硒为第四周期第ⅥA族元素,根据它在周期表中的位置推测,硒不可能具有的性质是( )| A. | 硒化氢的稳定性比水的弱 | |
| B. | 硒化氢的水溶液显弱酸性 | |
| C. | 硒的氧化性比硫的强 | |
| D. | 硒的最高价氧化物对应的水化物酸性比砷的强 |
分析 硒为第四周期第ⅥA族元素,其性质与O、S元素相似但非金属性小于O元素、S元素;
A.元素的非金属性越强,其氢化物的稳定性越强;
B.H2Se与H2S性质类似,H2S的水溶液显弱酸性;
C.元素的非金属性越强,其单质的氧化性越强;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强.
解答 解:硒为第四周期第ⅥA族元素,其性质与O、S元素相似但非金属性小于O元素、S元素;
A.元素的非金属性越强,其氢化物的稳定性越强,非金属性Se<O,则硒化氢的稳定性比水的弱,故A正确;
B.H2Se与H2S性质类似,H2S的水溶液显弱酸性,则硒化氢的水溶液显弱酸性,故B正确;
C.元素的非金属性越强,其单质的氧化性越强,非金属S>Se,则硒的氧化性比硫的弱,故C错误;
D.元素的非金属性越强,其最高价氧化物的水化物酸性越强,非金属性Se>As,则硒的最高价氧化物对应的水化物酸性比砷的强,故D正确;
故选C.
点评 本题考查元素周期律,为高频考点,明确同一周期、同一主族元素原子结构和性质递变规律是解本题关键,根据同一主族元素性质相似性和递变性分析解答,题目难度不大.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
8.下列化学用语正确的是( )
①OH-的电子式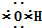
②乙烯的结构简式:CH2=CH2
③甲烷的结构式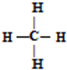
④乙烯的结构式:C2H4.
①OH-的电子式
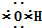
②乙烯的结构简式:CH2=CH2
③甲烷的结构式
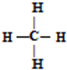
④乙烯的结构式:C2H4.
| A. | ①④ | B. | ②④ | C. | ②③ | D. | ①② |
12.TiO2和TiCl4都是钛的重要化合物,某化学兴趣小组在实验室对两者的制备及性质进行探究.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

请回答下列问题:
(1)仪器A的名称是球形干燥管.
(2)实验开始前的操作包括:①组装仪器,②检验装置气密性,③加装药品,④通N2一段时间,⑤最后点燃酒精灯.实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏 (或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL.
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的目的是:抑制NH4Fe(SO4)2水解.
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
Ⅰ.制备TiCl4
实验室利用反应TiO2 (s)+CCl4(g)$\frac{\underline{\;\;△\;\;}}{\;}$TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,装置图和有关信息如下:

| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是球形干燥管.
(2)实验开始前的操作包括:①组装仪器,②检验装置气密性,③加装药品,④通N2一段时间,⑤最后点燃酒精灯.实验结束后欲分离D中的液态混合物,所采用操作的名称是蒸馏 (或分馏).
(3)装置E能否不能(填“能”或“不能”)换成装置A,理由是装置A不能吸收空气中的氧气,不能保证反应在无氧环境下进行
(4)TiCl4是制取航天航空工业材料--钛合金的重要原料.某钛合金的元素还有Al和Si等,已知在常温下,钛是一种耐强酸强碱的金属,请设计实验检验其中的Si元素取少量合金样品于试管中,滴加过量NaOH溶液,振荡,静置后取上层清液,再逐滴滴入稀盐酸至过量,若有沉淀产生且最终沉淀不完全溶解,则证明样品中有Si
Ⅱ.制备TiO2及测定TiO2的质量分数:
在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2.
(5)写出生成TiO2•xH2O的化学方程式TiCl4+(x+2)H2O$\frac{\underline{\;\;△\;\;}}{\;}$TiO2•xH2O↓+4HCl.
(6)一定条件下,将TiO2溶解并还原为Ti3+,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+.滴定分析时,称取上述TiO2试样0.2g,消耗0.1mol•L-1 NH4Fe(SO4)2标准溶液20mL.
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
②该滴定操作所用到的指示剂是KSCN溶液.
③则TiO2质量分数为80%.
2.某反应的反应物X浓度在20s内由1.0mol•L-1变成了0.2mol•L-1,则以X浓度的变化表示的该反应在这段时间内的平均反应速率为( )
| A. | 0.04mol•L-1 | B. | 0.04mol•L-1•s-1 | C. | 0.08mol•L-1 | D. | 0.08mol•L-1•s-1 |
9.下列有机物溶液在适量的浓度时,不能用于杀菌消毒的是( )
| A. | 苯酚溶液 | B. | 乙醇溶液 | C. | 福尔马林 | D. | 乙酸乙酯溶液 |
18.A+、B2+、C-、D2- 四种离子核外电子排布相同,则这四种离子半径大小顺序是( )
| A. | C->D2->A+>B2+ | B. | B2+>A+>C->D2- | C. | B2+>A+>D2->C- | D. | D2->C->A+>B2+ |
