题目内容
14.按要求回答下列问题(1)键线式
 ,表示的分子式C6H14名称是2-甲基戊烷
,表示的分子式C6H14名称是2-甲基戊烷(2 ) 0.lmol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃的分子式为C6H12
(3 )支链只有一个乙基且相对分子量最小的烷烃的结构简式
 .
.
分析 (1)根据该有机物的键线式写出分子式,根据系统命名法完成该有机物的命名;
(2)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.6mol×2}{0.1mol}$=12,据此确定该有机物分子式;
(2)烷烃中出现乙基,则主链至少含有5个C,据此写出该有机物的结构简式.
解答 解:(1) ,分子中含有6个碳原子,属于饱和烃,分子式为C6H14,该有机物主链上有5个C,2号C一个甲基,其名称为:2-甲基戊烷,
,分子中含有6个碳原子,属于饱和烃,分子式为C6H14,该有机物主链上有5个C,2号C一个甲基,其名称为:2-甲基戊烷,
故答案为:C6H14;2-甲基戊烷;
(2)0.1mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6mol,则该烃分子中N(C)=$\frac{0.6mol}{0.1mol}$=6、N(H)=$\frac{0.6mol×2}{0.1mol}$=12,故该烃的分子式为:C6H12,
故答案为:C6H12;
(3)烷烃中含有乙基,则乙基至少在3号位,所以只有一个乙基且式量最小的烷烃的结构简式为: ,
,
故答案为: .
.
点评 本题考查了有机物分子式、结构简式的确定,题目难度不大,涉及有机物命名、有机物分子式、结构简式的计算,明确常见有机物的组成、结构与命名原则为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
4.下列说法中,不正确的是( )
| A. | 光合作用是将光能转化为化学能的有效途径 | |
| B. | 煤,石油,天然气都是可再生的化石燃料 | |
| C. | 用植物秸秆制沼气是有效利用生物质能的方式之一 | |
| D. | 开发氢能,太阳能,风能,生物质能等是实现“低碳生活”的有效途径 |
2.某反应的反应物X浓度在20s内由1.0mol•L-1变成了0.2mol•L-1,则以X浓度的变化表示的该反应在这段时间内的平均反应速率为( )
| A. | 0.04mol•L-1 | B. | 0.04mol•L-1•s-1 | C. | 0.08mol•L-1 | D. | 0.08mol•L-1•s-1 |
9.下列有机物溶液在适量的浓度时,不能用于杀菌消毒的是( )
| A. | 苯酚溶液 | B. | 乙醇溶液 | C. | 福尔马林 | D. | 乙酸乙酯溶液 |
3.鉴别下列各组物质,选用的试剂或方法错误的是( )
| 选项 | 要鉴别的物质组 | 试剂 | 方法 |
| A | NaCl/Na2CO3 | BaCl2溶液 | 观察是否产生沉淀 |
| B | NO2/Br2 | 湿润的淀粉碘化钾试纸 | 观察试纸是否变蓝色 |
| C | 乙醇/乙酸 | 新制氢氧化铜悬浊液 | 观察溶液是否变澄清 |
| D | CO2/SO2 | 品红溶液 | 观察溶液红色是否退去 |
| A. | A | B. | B | C. | C | D. | D |
15.工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如图1:
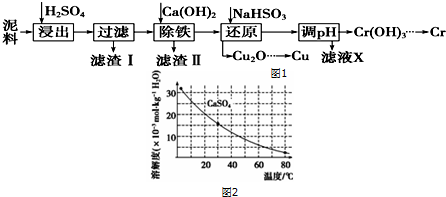
已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有CuSO4.
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].

已知部分物质沉淀的pH如下表,CaSO4的溶解度曲线如图2:
| 物质 | Fe3+ | Cu2+ | Cr3+ |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:
①加入石灰乳调节pH范围是3.2~4.3,检验Fe3+已经除尽的操作是取适量滤液,加KSCN溶液,若不变红,则说明Fe3+已除;
②将浊液加热到80℃,趁热过滤
(3)写出还原步骤中加入NaHSO3生成Cu2O固体反应的离子方程式:2H2O+HSO3-+2Cu2+=Cu2O↓+SO42-+5H+,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是产生SO2污染环境.
(4)当离子浓度小于或等于1×10-5mol•L-1时可认为沉淀完全,若要使Cr3+完全沉淀则要保持c(OH-)≥4.0×10-9 mol•L-1.[已知:Ksp[Cr(OH)3]=6.3×10-31,$\root{3}{63}$≈4.0].