题目内容
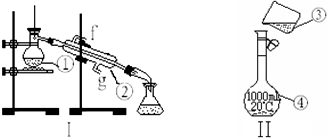
4.下列误差偏大的是( )| A. | 配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 | |
| B. | 转移到容量瓶过程中,有少量溶液溅出 | |
| C. | 转移后未洗涤小烧杯和玻璃棒 | |
| D. | 定容时仰视刻度线 |
分析 根据实验操作对c=$\frac{n}{V}$产生的影响进行分析,详细情况见解答.
解答 解:A、未经冷却立即转移到容量瓶中并定容,溶液体积偏小,浓度偏高,故A正确;
B、转移过程中有少量液体溅出,造成溶质损失,浓度偏低,故B错误;
C、没有洗涤烧杯和玻璃棒,使得溶质减少,浓度偏低,故C错误;
D、定容时仰视刻度线,溶液体积偏大,浓度偏低,故D错误.
故选:A.
点评 本题考查了配制一定物质的量浓度的溶液步骤及误差分析,题目难度不大,注意熟练掌握配制一定物质的量浓度的溶液的方法,多积累误差分析的方法和技巧.

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目
15.小明同学的化学纠错本上有如下内容,其中原因分析及改正有误的是( )
| 错误 | 原因分析及改正 | |
| A | FeBr2溶液中通入少量Cl2的离子方程式: 2Br-+Cl2═Br2+2Cl- | 还原性强弱:Fe2+>Br-; 改正:2Fe2++Cl2=2Fe3++2Cl-. |
| B | 除去CO2中的HCl气体:通过饱合Na2CO3溶液,分离方法:洗气 | “饱合”应为“饱和”,Na2CO3不仅要吸收HCl气体,还要吸收CO2,应改用饱和NaHCO3溶液;分离方法:洗气. |
| C | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液.指示剂:甲基橙,终点判断:当滴至最后一滴标准液,溶液由黄色变为橙色,即达终点. | 指示剂不能用甲基橙,改用酚酞,终点判断:当滴至最后一滴标准液,溶液由红色变为浅红色,即达终点. |
| D | 双原子分子一定是非极性分子 | 双原子分子有可能为单质或化合物分子; 改正:双原子单质分子一定是非极性分子而双原子化合物分子一定是极性分子. |
| A. | A | B. | B | C. | C | D. | D |
13.反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是( )
| A. | KSCN溶液、氯水 | B. | 稀盐酸、KMnO4溶液 | ||
| C. | 稀硫酸、KMnO4溶液 | D. | NaOH溶液 |
20.下列物质含氮量最高的是( )
| A. | 硫铵 | B. | 碳铵 | C. | 硝铵 | D. | 尿素 |
13.下列离子方程式正确的是( )
| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠跟冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
 .
.