题目内容
20.下列物质含氮量最高的是( )| A. | 硫铵 | B. | 碳铵 | C. | 硝铵 | D. | 尿素 |
分析 化学式中元素质量分数=$\frac{该元素总相对原子质量}{化合物相对分子质量}$×100%.硫铵为(NH4)2SO4,碳铵为NH4HCO3,硝铵为NH4NO3,尿素为CO(NH2)2,将碳铵改写为(NH4)2(HCO3)2,分子式中均含有2个N原子,相对分子质量越小,氮元素含量越高,
解答 解:硫铵为(NH4)2SO4,碳铵为NH4HCO3,硝铵为NH4NO3,尿素为CO(NH2)2,将碳铵改写为(NH4)2(HCO3)2,分子式中均含有2个N原子,相对分子质量越小,氮元素含量越高,
相对分子质量:(NH4)2(HCO3)2>(NH4)2SO4>NH4NO3>CO(NH2)2,
故CO(NH2)2的含氮量最高,
故选:D.
点评 本题考查化学式中元素质量分数计算,比较基础,根据质量分数定义利用改写方法确定N原子数目相等,再比较化合物相对分子质量,避免计算具体数据.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.某固体粉末X中可能含有K2SO4、(NH4)2CO3、K2SO3、NaNO3、Cu2O、FeO、Fe2O3中的若干种.某同学为确定该固体粉末的成分,取X进行如下实验,实验过程及现象如图所示.该同学得出的结论正确的是( )
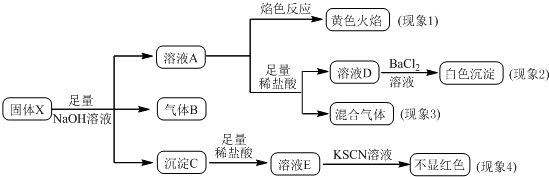
已知:Cu2O+2H+=Cu2++Cu+H2O.

已知:Cu2O+2H+=Cu2++Cu+H2O.
| A. | 根据现象1可推出该固体粉末中一定含有NaNO3 | |
| B. | 根据现象2可推出该固体粉末中一定含有K2SO4 | |
| C. | 根据现象3可推出该固体粉末中一定含有K2SO3 | |
| D. | 根据现象4可推出该固体粉末中一定没有Fe2O3 |
15.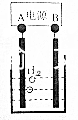 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
 用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.
用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷.已知电解总反应为:2C6H13COONa+2CH3OH$\frac{\underline{\;通电\;}}{\;}$C12H26+2CO2↑+H2↑+2CH3ONa,
下列说法不正确的是( )
| A. | 图中电源的A极为直流电源的负极 | |
| B. | 加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性 | |
| C. | 阳极电极反应为:2C6H13COO--2e-=C12H26+2CO2↑ | |
| D. | 反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备 |
4.下列误差偏大的是( )
| A. | 配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 | |
| B. | 转移到容量瓶过程中,有少量溶液溅出 | |
| C. | 转移后未洗涤小烧杯和玻璃棒 | |
| D. | 定容时仰视刻度线 |
11.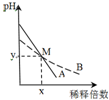 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )| A. | 稀释前,c(A)>10 c(B) | |
| B. | 中和等浓度等体积的盐酸时,B用的体积较多 | |
| C. | M点时A和B的浓度相等 | |
| D. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 |
8.25℃时,在10mL浓度均为0.1mol/L的醋酸和盐酸的混合溶液中,滴加0.1mol/L的NaOH溶液V mL,则溶液中粒子浓度关系正确的是( )
| A. | V=0时:[H+]>[Cl-]=[CH3COOH] | B. | V=10 mL时:[OH-]+[CH3COO-]=[H+] | ||
| C. | V=20 mL时:[Na+]=[CH3COO-]+[Cl-] | D. | 加入NaOH溶液至pH=7时,V>20 mL |
 ;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O.
;D所在族元素的氢化物中,稳定性最强的是(填化学式)H2O.