题目内容
13.下列离子方程式正确的是( )| A. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| B. | 氢氧化铝与足量盐酸反应:Al(OH)3+3H+═Al3++3H2O | |
| C. | 钠跟冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 铜片与稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
分析 A.铁与稀硫酸反应生成硫酸亚铁和氢气;
B.氢氧化铝与盐酸反应生成氯化铝和水;
C.离子方程式两边正电荷不相等,违反了电荷守恒;
D.离子方程式两边总电荷不相等,违反了电荷守恒.
解答 解:A.铁与稀硫酸反应生成硫酸亚铁,正确的离子方程式为:Fe+2H+═Fe3++H2↑,故A错误;
B.氢氧化铝与足量盐酸反应生成氯化铝和水,反应的离子方程式为:Al(OH)3+3H+═Al3++3H2O,故B正确;
C.钠跟冷水反应氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故C错误;
D.铜片与稀硝酸反应生成硝酸铜、一氧化氮气体和水,正确的离子方程式为:3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故D错误;
故选B.
点评 本题考查了离子方程式的正误判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
4.下列误差偏大的是( )
| A. | 配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 | |
| B. | 转移到容量瓶过程中,有少量溶液溅出 | |
| C. | 转移后未洗涤小烧杯和玻璃棒 | |
| D. | 定容时仰视刻度线 |
8.25℃时,在10mL浓度均为0.1mol/L的醋酸和盐酸的混合溶液中,滴加0.1mol/L的NaOH溶液V mL,则溶液中粒子浓度关系正确的是( )
| A. | V=0时:[H+]>[Cl-]=[CH3COOH] | B. | V=10 mL时:[OH-]+[CH3COO-]=[H+] | ||
| C. | V=20 mL时:[Na+]=[CH3COO-]+[Cl-] | D. | 加入NaOH溶液至pH=7时,V>20 mL |
5.在一个固定体积的密闭容器中,保持一定温度,进行以下反应:H2(g)+I2(g)?2HI(g).已知起始时加入1mol H2和2mol I2(g),当达到平衡时H2的体积分数为φ.下列四种情况分别投入上述容器,且始终保持原温度,平衡时H2的体积分数也为φ的是( )
| A. | 2 mol H2(g)和1 mol I2(g) | B. | 3 mol HI(g) | ||
| C. | 2 mol H2(g)和2 mol I2(g) | D. | 1 mol I2(g)和2 mol HI(g) |
3.下列各组物质中化学键的类型完全相同的是( )
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
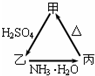 甲、乙、丙三种物质之间有如右图所示的转化关系:
甲、乙、丙三种物质之间有如右图所示的转化关系: