题目内容
15.小明同学的化学纠错本上有如下内容,其中原因分析及改正有误的是( )| 错误 | 原因分析及改正 | |
| A | FeBr2溶液中通入少量Cl2的离子方程式: 2Br-+Cl2═Br2+2Cl- | 还原性强弱:Fe2+>Br-; 改正:2Fe2++Cl2=2Fe3++2Cl-. |
| B | 除去CO2中的HCl气体:通过饱合Na2CO3溶液,分离方法:洗气 | “饱合”应为“饱和”,Na2CO3不仅要吸收HCl气体,还要吸收CO2,应改用饱和NaHCO3溶液;分离方法:洗气. |
| C | 用已知浓度的HCl溶液滴定未知浓度的NaOH溶液.指示剂:甲基橙,终点判断:当滴至最后一滴标准液,溶液由黄色变为橙色,即达终点. | 指示剂不能用甲基橙,改用酚酞,终点判断:当滴至最后一滴标准液,溶液由红色变为浅红色,即达终点. |
| D | 双原子分子一定是非极性分子 | 双原子分子有可能为单质或化合物分子; 改正:双原子单质分子一定是非极性分子而双原子化合物分子一定是极性分子. |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二价铁还原性大于溴离子;
B.二氧化碳能与碳酸钠反应;
C.滴定终点是当最后一滴盐酸溶液滴入时,溶液颜色由浅红色变为无色;
D.双原子分子有可能为单质或化合物分子.
解答 解:A.二价铁还原性大于溴离子,氯气先与溴离子反应,故A正确;
B.二氧化碳能与碳酸钠反应,应用饱和碳酸氢钠,故B正确;
C.用酚酞做指示剂,滴定终点是当最后一滴盐酸溶液滴入时,溶液颜色由浅红色变为无色,且半分钟内不变色,故C错误;
D.双原子分子有可能为单质或化合物分子,如氮气为非极性分子,氯化氢为极性分子,故D正确.
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及还原性比较、除杂、中和滴定以及分子的极性等,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.

练习册系列答案
相关题目
5.如图是部分短周期元素原子半径与原子序数的关系图.下列说法正确的是( )
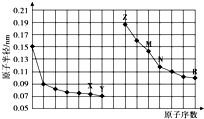

| A. | 最高价氧化物对应水化物的碱性:Z<M | |
| B. | Y、R两种元素气态氢化物的沸点:Y<R | |
| C. | X、N两种元素组成的化合物不与任何酸反应 | |
| D. | 简单离子的半径:Z<X<R |
7.下列有关烃的系统命名正确的有( )
| A. | 2,3-二甲基-3,3-二乙基戊烷 | B. | 2-甲基-3-乙基丁烷 | ||
| C. | 2,3-二甲基-1-丁烯 | D. | 2,3-二甲基-1-丁炔 |
4.下列误差偏大的是( )
| A. | 配制NaOH溶液时,将称量好的NaOH固体放入小烧杯中溶解,未经冷却立即转移到容量瓶中并定容 | |
| B. | 转移到容量瓶过程中,有少量溶液溅出 | |
| C. | 转移后未洗涤小烧杯和玻璃棒 | |
| D. | 定容时仰视刻度线 |
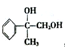 ,G可用作工业增塑剂.回答下列问题:
,G可用作工业增塑剂.回答下列问题: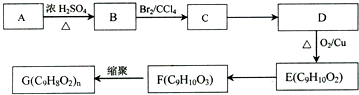
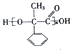 ,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为
,已知A的一种同分异构体也能转化为B,则该同分异构体的结构简式为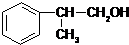 .
.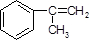 +Br2→
+Br2→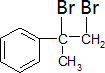 .
.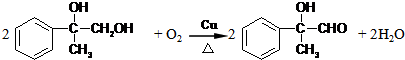 .
. .
.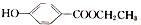 )是一种常用的食品添加剂,合成路线如下:
)是一种常用的食品添加剂,合成路线如下: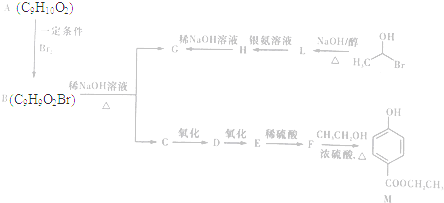
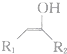 $\stackrel{不稳定、自动转化}{→}$
$\stackrel{不稳定、自动转化}{→}$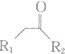 (R1、R2为H或烃基)
(R1、R2为H或烃基) 与稀氢氧化钠溶液不反应
与稀氢氧化钠溶液不反应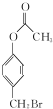 +3NaOH$\stackrel{△}{→}$
+3NaOH$\stackrel{△}{→}$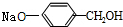 +CH3COONa+H2O+NaBr;
+CH3COONa+H2O+NaBr;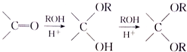 由乙烯、甲醇为有机原料制备化合物
由乙烯、甲醇为有机原料制备化合物 的合成路线流程图(无机试剂任选)如下:
的合成路线流程图(无机试剂任选)如下: